
کلینیک جامع آموزش پزشکی
همچنین می توانید کانال ما در تلگرام را دنبال کنید با عنوان: نکات مهم سلامتی t.me/public_health
کلینیک جامع آموزش پزشکی
همچنین می توانید کانال ما در تلگرام را دنبال کنید با عنوان: نکات مهم سلامتی t.me/public_healthخون بندناف یک سرمایه سلامتی است
سرطان خون نیز از آن دسته سرطانهایی است
که بسیار مهلک بوده و سالانه افراد زیادی در جهان بر اثر عدم درمان جان
خود را از دست میدهند. اما با استفاده از ذخیره خون بندناف جفت جنین و
پیوند سلولهای بنیادی براحتی میتوان سرطان خون و برخی بیماریهای خونی را
درمان کرد.شاید این موهبت الهی است تا بندگان با اندکی تفکر و تدبیر در
مورد آن جان هزاران نفر را از این سرطان مهلک نجات دهند همچنین از آنجا که
عمر سلولهای بنیادی خون بندناف 20 سال است در صورت عدم استفاده خود فرد از
این اندوخته سلامتی، پدر و مادر، خواهر و برادر و افراد غیرخویشاوند نیز
در صورت تایید آزمایشات پزشکی میتوانند برای درمان از آن بهرهمند شوند.
خون
بندناف نیز اهدایی است که در دوران نقاهت میتوان به دیگران هدیه داد و
زندگی بخشید ..خون بندناف که به عنوان خون جفتی شناخته شده، خونی است که در
جنین در حال تکوین داخل رحم جریان دارد.پس از تولد نوزاد، خون باقیمانده
در بندناف و جفت که غنی از سلولهای بنیادی است به عنوان یک زباله بیولوژیک
دور ریخته میشود،سلولهای بنیادی که از بندناف گرفته میشوند بسیار
پرتوان و نامیرا هستند همچنین در اثر تاکثیرهای پیدرپی دچار پیری نمیشوند
به طوری که با تزریق و یا جایگزینی آنها در مناطقی که به صورت جدی آسیب
دیدهاند میتوانیم به بهبود آن کمک کنیم.
مادران باردار در
هفتههای آخر بارداری و در هفته 35 بارداری خود برای انجام برخی آزمایشها و
اقدامات اولیه به پزشک زنان و زایمان معرفی میشوند و در صورتیکه مشکلی
برای ذخیره وجود نداشته باشد، حداکثر چهار ساعت پس از زایمان خون گرفته شده
از بندناف جفت با پیک در باکسهای یخدار به سمت مرکز بانک خون رویان در
تهران انتقال داده میشود.فرآیند جمعآوری بندخون ناف به صورت کاملا
استریل، بدون درد و بدون دخالت در روند زایمان انجام میشود همچنین
خونگیری میتواند به صورت داخل و یا خارج رحمی انجام شود و در هر دو صورت
هیچ آسیبی به مادر و یا نوزاد وارد نمیشود و کل این فرآیند کمتر از پنج
دقیقه به طول میانجامد.
نمونه دریافت شده پس از ورود به آزمایشگاه
پردازش سلولی، ابتدا از نظر حجم و تعداد سلول مورد بررسی قرار گرفته و
عملیات جداسازی سلولهای بنیادی بر روی آن انجام میشود،بر روی نمونههایی
که حداقل شرایط استاندارد را دارند بررسی آزمایشهای میکروبی و ویروسی HLA،
سنجش کلونی و فلوسایتومتری انجام شده و در دمای منفی 196 درجه سانتیگراد
در تانکهای ویژه فریز برای مدت طولانی نگهداری میشود و در غیر این صورت
قرارداد فسخ و پس از اطلاع به خانواده مطابق قرارداد منعقد شده هزینههای
مصوب عودت میشود.
ذخیره خون بندناف یک سرمایه سلامتی برای آینده
افراد است.به دنبال کشف سلولهای بنیادی، این ایده پیش آمد که از سلولهای
بنیادی در امر درمان بسیاری از بیماریها استفاده شود و خون بندناف نیز
دارای سلولهای بنیادی است که در درمان برخی بیماریها کاربرد دارد.با
استفاده از سلولهای خون بندناف میتوان در آینده فردی را که دچار مشکل و
بیماری شده را به راحتی مورد درمان قرار داد.
با سرعت فزاینده رشد
این علم میتوان از سلولهای بنیادی برای درمان بیماری خود فرد، اعضا
خانواده و حتی غیرخویشاوند نیز بهره گرفت.زمانی که از ذخیره سلولهای خون
بندناف برای درمان بیماریهای غیر از خود فرد استفاده میشود باید
بررسیهای لازم از این جهت که آیا بدن فرد گیرنده این بافت را میپذیرد یا
نه، صورت گیرد.اگر نوزادی که خون بندناف جفتش ذخیره شده، در آینده دچار
بیماری و سرطان خون شود براحتی درمان انجام میگیرد چراکه این سلول مربوط
به خود فرد است و بدن آن را پس نمیزند.خون بندناف در بدو تولد از جفت
گرفته میشود سپس زواید آن را جدا کرده و بافت اولیه و سلولهای بنیادی
اولیه نیز استخراج و فریز میشود.
در حال حاضر سلولهای بنیادی در
درمان انواع سرطانهای خون، هموفیلی، لوسمی و کمخونیهای شدید کاربرد
دارد، در سلولهای بنیادی پتانسیل درمان نارسایی قلبی، پارکینسون، نقص عضو و
... نیز کاربرد دارد اما همه در حال تحقیق و بررسی است و هنوز به قطعیت
نرسیده است.استقبال و گرایش مادران نسبت به ذخیره خون بندناف در سالهای
اخیر افزایش یافته که این موضوع ناشی از افزایش آگاهی و شناخت مردم
است.مادران باردار باید در ماه آخر بارداری برای انجام آزمایشات و اقدامات
لازم مراجعه کنند، اگر مادر باردار مبتلا به بیماریهای عفونی باشد از آنجا
که احتمال عفونی بودن سلولها میرود امکان ذخیره خون بندناف وجود ندارد.
از
سلولهای خون بندناف برای پیوند سلولهای بنیادی مغز استخوان و درمان
سرطان خون استفاده میشود.هرچه ژنها از لحاظ منطقهای به یکدیگر نزدیک
باشند احتمال اینکه بتوان از سلولهای بنیادی برای درمان بیماریهای افراد
غیرخویشاوند استفاده کرد، بیشتر است.درمان بیماریهایی مانند تالاسمی و
هموفیلی توسط خون بندناف برای خود فردی که خون بندنافش ذخیره شده کاربرد
ندارد و برای دیگر افراد کاربرد درمانی دارد.بیماری آپلاستیک و کمخونی
شدید نیز توسط خون بندناف برای خود فرد به طور کامل قابل درمان است. چه خوب
است که این طرح همهگیر شود و همه مردم با ذخیره خون بندناف فرزندشان
علاوه بر ذخیره سلامتی برای خود به بیماران سرطانی کمک کنند.
انواع سرطان پوست کدامند؟
انواع سرطان پوست کدامند؟
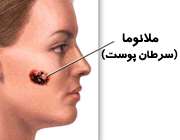
ملانوما، بدترین نوع سرطان پوست
بدخیمترین و جدیترین نوع سرطان پوست است و مسبب اکثر مرگهای بر اثر سرطان پوست میباشد. علت اصلی ملانوما ناشناخته است. اما عوامل متعددی از جمله عوامل ژنتیکی، تابش اشعه ماورای بنفش و تماسهای محیطی در ایجاد این بیماری دخیل است.
ملانوما از ملانوسیتهای پوست که استحاله بدخیمی پیدا کردهاند منشا میگیرد. ملانوسیتها، رنگدانه تیره پوست، مو، چشم و خالهای بدن را تولید میکنند. از این رو تومورهای ملانوما اکثراً قهوهای یا سیاه هستند. ولی در موارد معدودی نیز ملانوما رنگدانه تولید نکرده و به رنگ صورتی، قرمز یا بنفش ظاهر میشود.
نشانههای هشدار دهنده ملانوما چیست؟
عمده نشانههای هشدار دهنده ملانوما عبارتند از: تغییر در اندازه و شکل و رنگ یک خال، خونریزی از خال، احساس خارش، سفت شدن، ایجاد قلنبه، متورم شدن در محل خال، احساس ناراحتی هنگام دست دادن. ملانوما همچنین میتواند به صورت خال جدید در بدن ایجاد شود.
در صورتی که یک خال یا ناحیه رنگی پوست، طبیعی به نظر نرسد، پزشک با برش ظریفی در پوست و نمونه برداری، وجود یا عدم وجود سرطان را تشخیص خواهد داد.
چه افرادی بیشتر در معرض ابتلا به ملانوما هستند؟
* اگر تعداد خالهای معمولی بدن زیاد (بیش از 50 عدد) باشد، خطر بروز ملانوما بیشتر است.
* ملانوما در افراد با پوست روشن یا افرادی که دچار آفتاب سوختگی شدهاند یا افراد دارای کک و مک، زیاد دیده میشود.
- افرادی که تحت درمان ملانوما قرار دارند، خطر بیشتری برای ابتلا به ملانومای ثانویه دارند.
- افرادی که دارای یک یا چند سرطان پوستی هستند نیز در معرض خطر بیشتر ابتلا به ملانوما قرار دارند.
- گاهی اوقات ملانوما زمینه خانوادگی دارد و بودن یک یا چند فرد مبتلا در خانواده، عامل خطر به حساب میآید. زمانی که ملانوما در یکی از اعضای خانواده به وجود میآید، سایر افراد خانواده باید به طور منظم، توسط پزشک معاینه شوند.
- افرادی که سیستم ایمنی آنان در اثر سرطان، داروهای مصرفی در پیوند عضو و ایدز تضعیف شده است، در معرض خطر بیشتر ابتلا به بیماری قرار دارند.
- افرادی که دارای حداقل یک آفتاب سوختگی در زمان کودکی یا نوجوانی بودهاند، بیشتر در معرض ابتلا به ملانوما هستند.
- هر چه طول مدت زمانی که فرد در مقابل اشعه خورشید قرار میگیرد بیشتر باشد، خطر ابتلا به ملانوما بیشتر میشود.
انواع دیگر سرطان پوست کداماند؟
شاخی شدن پوست در اثر آفتاب (اکتینیک کراتوزیس)
ضایعات پوستی کوچکی هستند که پوسته ریزی دارند و در اثر تماس طولانی با نور خورشید ایجاد میشوند و بیشتر در سر، گردن، دستها ایجاد میشوند. ممکن است این ضایعات در نواحی دیگر بدن نیز ایجاد شوند. ممکن است این ضایعات پوستی اولین نشانههای سرطان پوست باشند. افراد سفید پوست با موهای بور و چشمان روشن بیشتر در معرض خطر هستند. درمان زودرس ضایعات، برای جلوگیری از تبدیل آنها به سرطان سلول سنگفرشی پوست، توصیه میشود.
التهاب شاخی لب
مانند ضایعه قبلی التهاب شاخی لب نیز یک ضایعه پیش سرطانی است که معمولاً در لب پایینی ظاهر میشود. در لبها، ضایعات پوسته دار، خشکی دائمی لب یا ترک لب ممکن است بروز کنند. علائمی که شیوع کمتری دارند شامل تورم لب، از بین رفتن مرز بین لب و پوست صورت یا برجسته شدن خطوط لب هستند. التهاب شاخی لب، اگر درمان نشود ممکن است به سرطان سلول سنگفرشی تبدیل شود.
شاخک پوستی
این ضایعه پوستی به شکل یک برآمدگی مخروطی شکل است که از یک پایه قرمز رنگ در سطح پوست رو به خارج رشد میکند. این ضایعه از کراتین (همان مادهی تشکیل دهندهی ناخن) تشکیل شده است. شکل و اندازهی این ضایعات بسیار متفاوت است، اما بیشتر آنها چند میلیمتر هستند. بدخیمی سلول سنگفرشی پوست اغلب در پایهی این ضایعات ایجاد میشود. این ضایعات در سفید پوستان مسنی که سابقه مواجهه زیاد با آفتاب را دارند دیده میشود.
سرطان سلول سنگفرشی
در این بیماری سلولهای سنگفرشی پوست، سرطانی میشوند. این نوع سرطان ممکن است به صورت برآمدگی نرم، قرمز رنگ و پوستهداری تظاهر کند که رشد میکند و ممکن است خونریزی یا ترشح داشته باشد و یا ممکن است به صورت یک زخم بروز کند که خوب نمیشود. بیشتر اوقات در بینی، پیشانی، گوشها، لب پایینی و مناطقی از بدن که بیشتر در معرض نور آفتاب هستند، ایجاد میشود. این نوع سرطان در صورتی که زود تشخیص داده شود، به خوبی درمانپذیر است. اما اگر دیر تشخیص داده شود، درمان به میزان پیشرفت بیماری بستگی دارد.
سرطان سلول پایهای
در این بیماری سلولهای پایهای پوست بدخیم میشوند. این نوع بدخیمی پوست، شایعترین و قابل درمان ترین نوع سرطان پوست است، زیرا این بیماری به کندی پیشرفت میکند. ضایعات سرطانی ممکن است شکلهای مختلفی داشته باشند؛ ممکن است به شکل یک ضایعه گرد، سفید رنگ و مروارید شکل و یا به صورت برآمدگی پر از چربی باشد که اغلب عروق کوچکی هم در آن دیده میشود. ضایعه میتواند در گوشها، گردن یا صورت ایجاد شود. ممکن است ضایعات پوستی به صورت صاف، پوسته دار، صورتی یا قهوهای باشند که در پشت تنه یا روی سینه ایجاد میشوند.
کاربردهای سلولهای بنیادی در پزشکی-دانلود
تولید اینترفرونها در زمان خود، انقلاب در پزشکی محسوب شد و این امیدواری
را پیش آورد که بتواند بهعنوان درمان قطعی سرطان مورد استفاده قرار گیرد؛
اما گذشت زمان برخی محدودیتهای آن را نمایان ساخت.
پس از آن، ژندرمانی به عنوان راهی برای درمان سرطان مطرح شد که سر و صدای
زیادی در مجامع علمی و پزشکی به راه انداخت؛ در این تکنولوژی، معمولاً از
ویروسها به عنوان ناقلین ژنها استفاده میشود که مشکلاتی همچون
تومورزایی، بیماریزایی و غیره را به همراه دارد و لذا این روش نیز با
محدودیتهای جدی روبرو شد.
امروزه یکی از کاربردهای سلولهای بنیادی که توجه زیادی را به خود معطوف
داشته است، همین
 درمان سرطان است؛ چرا که از سلولهای بنیادی انسانی و معمولاً
بدون تغییر ژنتیکی، میتوان برای ترمیم بافتهای آسیب دیده استفاده کرد.
درمان سرطان است؛ چرا که از سلولهای بنیادی انسانی و معمولاً
بدون تغییر ژنتیکی، میتوان برای ترمیم بافتهای آسیب دیده استفاده کرد.
هر چند استفاده از سلولهای بنیادی، در مراحل اولیه خود به سر میبرد، اما
متخصصین معتقدند در آیندهای نهچندان دور، کاربردهای وسیعی در علم پزشکی
خواهد داشت. با این اعتقاد، هماکنون در اقصی نقاط جهان تحقیقات وسیعی در
خصوص استفاده از سلولهای بنیادی در جهت تأمین سلامت انسان در حال انجام
است. در ذیل به چند نمونه از کاربردهای نزدیک به حصول سلولهای بنیادی
اشاره میشود:
1- ترمیم بافتهای آسیبدیده قلب
امروزه شمار زیادی از مردم دنیا از بیماریهای قلبی ناشی از آ?سیبدیدگی بافتهای آن رنج میبرند که بعضاً منجر به مرگ نیز میشود.
 ترمیم بافتهای
آسیبدیده، همواره یکی از دغدغههای پزشکان و متخصصین علوم پزشکی بوده و
بهرهگیری از سلولهای بنیادی، امید تازهای در این عرصه به وجود آورده
است. متخصصین امیدوارند سلولهای بنیادی را از مغز استخوان افراد بیمار (یا
جنین نوظهور) استخراج و آنها را در محیط آزمایشگاه به سلولهای قلبی تبدیل
نمایند و نهایتاً با تزریق این سلولهای تمایزیافته به بدن، امکان ترمیم
بافتهای آسیبدیده قلب را فراهم آورند.
ترمیم بافتهای
آسیبدیده، همواره یکی از دغدغههای پزشکان و متخصصین علوم پزشکی بوده و
بهرهگیری از سلولهای بنیادی، امید تازهای در این عرصه به وجود آورده
است. متخصصین امیدوارند سلولهای بنیادی را از مغز استخوان افراد بیمار (یا
جنین نوظهور) استخراج و آنها را در محیط آزمایشگاه به سلولهای قلبی تبدیل
نمایند و نهایتاً با تزریق این سلولهای تمایزیافته به بدن، امکان ترمیم
بافتهای آسیبدیده قلب را فراهم آورند.البته این تکنیک هنوز در مرحله آزمایشگاهی است، اما موفقیتهای بهدست آمده در حیوانات آزمایشگاهی، احتمال بهرهگیری از آن را در انسان قوت بخشیده است.
2- ترمیم بافتهای استخوانی
در افرادی که شکستگی وسیع استخوان دارند و یا کسانی که مورد عمل جراحی مغزی قرار گرفته و کاسه سر آنها برداشته شده و همچنین اشخاصی که استخوانهای آنها بهکندی جوش میخورد،
 از سلولهای بنیادی برای جوشخوردگی سریع و جلوگیری از
عفونتهای بعدی استفاده میشود. در این تکنیک، سلولهای بنیادی مزانشیمی از
فرد گرفته شده و در محیط آزمایشگاه به سلولهای استئوپلاست (استخوانی)
تبدیل میشوند، سپس این سلولها در کنار بافتهای آسیبدیده استقرار
مییابند تا باعث جوشخوردگی سریع این بافتها گردند. در این مورد، سلولها
از خود شخص جدا میشوند؛ بنابراین مشکل پسزدگی و عوارض جانبی را نیز در
برندارد.
از سلولهای بنیادی برای جوشخوردگی سریع و جلوگیری از
عفونتهای بعدی استفاده میشود. در این تکنیک، سلولهای بنیادی مزانشیمی از
فرد گرفته شده و در محیط آزمایشگاه به سلولهای استئوپلاست (استخوانی)
تبدیل میشوند، سپس این سلولها در کنار بافتهای آسیبدیده استقرار
مییابند تا باعث جوشخوردگی سریع این بافتها گردند. در این مورد، سلولها
از خود شخص جدا میشوند؛ بنابراین مشکل پسزدگی و عوارض جانبی را نیز در
برندارد.تکنیک مذکور از مرحله آزمایشگاهی خارج شده و هماکنون درکشورهای پیشرفته دنیا از جمله آمریکا و ژاپن به طور عملی و کاربردی بر روی بیماران انجام میشود.
3- درمان بیماریها و ضایعات عصبی
پیشرفتهای بشر در زمینه تولید، تکثیر و تمایز سلولهای بنیادی، این امید را به وجود آورده است که بتوان از این سلولها در مداوای ضایعات عصبی مانند
 قطع نخاع و
بیماریهای عصبی همچون آلزایمر، پارکینسون، MS و غیره نیز بهره برد. در
این مورد نیز پس از تهیه سلولهای بنیادی از شخص موردنظر، آنها را به سلول
عصبی تبدیل نموده و برای ترمیم یا مداوا مورد استفاده قرار میدهند. البته
بخش اعظم این تکنولوژی، در مرحله آزمایشگاهی است؛ اما با پیشرفتهای خوبی
همراه بوده است. بهعنوان مثال، طی گزارشی که اخیراً منتشره شده، متخصصین
فرانسوی موفق شدند با استفاده از سلولهای مزانشیمی، موش قطع نخاع شدهای
را تا حدی بهبود بخشند که قادر به حرکت باشد ( البته نه با تعادل صددرصد).
این موضوع در صورتیکه با موفقیت نهایی توأم شود، انقلاب بزرگی در پزشکی به
شمار میرود.
قطع نخاع و
بیماریهای عصبی همچون آلزایمر، پارکینسون، MS و غیره نیز بهره برد. در
این مورد نیز پس از تهیه سلولهای بنیادی از شخص موردنظر، آنها را به سلول
عصبی تبدیل نموده و برای ترمیم یا مداوا مورد استفاده قرار میدهند. البته
بخش اعظم این تکنولوژی، در مرحله آزمایشگاهی است؛ اما با پیشرفتهای خوبی
همراه بوده است. بهعنوان مثال، طی گزارشی که اخیراً منتشره شده، متخصصین
فرانسوی موفق شدند با استفاده از سلولهای مزانشیمی، موش قطع نخاع شدهای
را تا حدی بهبود بخشند که قادر به حرکت باشد ( البته نه با تعادل صددرصد).
این موضوع در صورتیکه با موفقیت نهایی توأم شود، انقلاب بزرگی در پزشکی به
شمار میرود.ضمن اینکه یک شرکت آمریکایی بنام اورسی که یک مرکز تحقیقاتی خصوصی بوده و متخصصین ارشد جهان در زمینه سلولهای بنیادی را گرد هم آورده، ادعا کرده است که قادر به مداوای بیماریهایی مانند آلزایمر، پارکینسون، MS و غیره میباشد که این عمل را با استفاده از سلولهای بنیادی خود شخص انجام میدهد؛ البته در قبال آن هزینههای بالایی تا حد 100 هزار دلار دریافت مینمایند.
4- ترمیم سوختگیها و ضایعات پوستی
جراحات پوستی ناشی از سوختگی یا صدمات دیگر، بسیاری از بیماران را به خود مبتلا نموده است. در روش معمول برای ترمیم قسمتهای صدمهدیده،
5- ترمیم لوزالمعده (پانکراس) و ترشح انسولین
اخیراً در دانشگاه آلبرتا کانادا، متخصصین موفق شدند سلولهای بنیادی مزانشیمی را به سلولهای پانکراس انسانی تبدیل
 نمایند و به
بیماران دیابتی منتقل نمایند. این آزمایش بر روی 23 نفر انجام شد که 16 نفر
از تزریق انسولین بینیاز شدند. یادآوری میشود که این پیوند از نوع
اتولوگ بود (برای مداوای هر شخص از سلولهای بنیادی خود وی استفاده شد) و
مشکلات جانبی در بر نداشت.
نمایند و به
بیماران دیابتی منتقل نمایند. این آزمایش بر روی 23 نفر انجام شد که 16 نفر
از تزریق انسولین بینیاز شدند. یادآوری میشود که این پیوند از نوع
اتولوگ بود (برای مداوای هر شخص از سلولهای بنیادی خود وی استفاده شد) و
مشکلات جانبی در بر نداشت.6- آزمون تأثیر داروهای جدید
داروهای سنتتیک جدید ممکن است بر سلولها یا بافتهای انسانی تأثیرات متفاوتی داشته باشند که امکان تست
7- ترمیم سایر بافتهای آسیبدیده
مواردی که اشاره شد کاربردهایی از سلولهای بنیادی بود که به صورت کاربردی درآمده بودند و یا نزدیک به کاربردی شدن هستند، اما از کاربردهای بالقوه این سلولها میتوان به ترمیم بافتهای آسیب دیده دیگر بدن از جمله غضروف، کبد، ماهیچه و غیره اشاره کرد که میتواند دامنه کاربرد سلولهای بنیادی را در آینده افزایش دهد.
یک نکته مهم
در اطلاعرسانی عمومی کاربرد سلولهای بنیادی، باید به این نکته توجه شود که انتظارات بیش از حد توانایی این تکنولوژی در مردم به وجود نیاید.
با این تفاسیر، کاربرد قابل انتظار بهرهگیری از سلولهای بنیادی در شرایط فعلی و آینده نزدیک، ترمیم بافتهای آسیبدیده است که در موارد فوق به آنها اشاره شد. هر چند همین کاربردها نیز در صورت فراگیرشدن، انقلابی در پزشکی محسوب میشوند.
سلول های بنیادی چه هستند؟
سلول های بنیادی چه هستند؟
* سلول های بنیادی چه هستند و چگونه عمل می کنند ؟
سلول های بنیادی یا STEM CELLS به سلول های چند پتانسیلی مغز استخوان گفته می شود که توانایی تبدیل به انواع سلول های خونی را دارند. توانایی تبدیل این سلول ها به انواع سلول های خونی، توجه دانشمندان و پژوهشگران را به طرف تبدیل این سلول ها به سایر سلول های تخصص یافته ی بافت های دیگر معطوف داشت.
در کلیه ی بافت های بدن نوعی از سلول های بنیادی یافت می شود که توانایی تبدیل به سلول های تخصص یافته ی همان بافت را دارند و در موقع اختلال بافتی، دست به کار شده و تکثیر پیدا می کنند و به دلیل داشتن همین توانایی به آنها " سلول بنیادی" می گویند.
سلول های بنیادی اصولا سلول های تخصصی نشده ای هستند که با دو مشخصه مهم از دیگر سلول ها تفکیک می شوند:
اولا توانایی تکثیر و افزایش تعداد برای مدت طولانی را دارند.
دوم اینکه پس از دریافت پیام های شیمیایی معین می توانند تمایز حاصل کنند یا به سلول های تخصص یافته ای با عملکردهای خاص، مثل سلول قلبی یا عصبی تبدیل شوند. عملکرد این سلول ها در بدن این است که در هنگام اختلال و بیماری تکثیر شده و سلول های جدیدی به بافت ارائه می کنند که اساس سلول درمانی را تشکیل می دهد.
سلول های بنیادی بر اساس توانایی تکثیر و تمایز به انواع مختلفی تقسیم می شوند:
1- سلول های بنیادی TOTIPOTENT یا همه توانی:
این سلول ها می توانند به هر نوع سلولی در بدن تغییر پیدا کرده و تبدیل شوند. یک تخمک بارور شده در واقع یک نوع سلول بنیادی همه توانی است. سلول های تولید شده در تقسیمات تخمک بارور شده نیز همه توانی هستند.
2- سلول های بنیادی PLURIPOTENT یا پرتوانی:
این سلول ها که از سلول های بنیادی رویان منشا می گیرند، حدود 4 روز پس از لقاح به وجود می آیند و می توانند به هر نوع سلولی به جز سلول های بنیادی همه توانی و سلول های جفت تبدیل شده و تمایز حاصل کنند.
3- سلول های بنیادی MULTIPOTENT یا چند توانی :
از سلول های بنیادی پرتوانی منشا می گیرند و سلول های تخصص یافته از آنها ناشی می شوند. برای مثال سلول های بنیادی خون ساز که در مغز استخوان وجود دارند به همه انواع سلول موجود در خون تبدیل می شوند، مثل گلبول قرمز، گلبول سفید و پلاکت. یا سلول های بنیادی عصبی که می توانند به سلول های عصبی و سلول های حمایت کننده عصبی تبدیل شوند.
4- سلول های بنیادی UNIPOTENT یا تک توانی :
این نوع سلول ها می توانند فقط به یک نوع سلول تبدیل شده و آن را تولید کنند.
* سلول درمانی چیست و چگونه از سلول های بنیادی برای سلول درمانی استفاده می شود؟
سلول درمانی در واقع عمل پیوند سلول های خویش منشا یا اتولوگ است. روشی که در حال حاضر تحت عنوان سیستم سلولی اتولوگ یا AUTOLOGOUS CELLULAR SYSTEM مطرح می گردد.
در این روش درمانی سلول های خود فرد تکثیر شده و مجدد به محل مورد نظر تزریق می شود تا اختلال ایجاد شده رفع شود
سلول های بنیادی
سلولهای بنیادی سلول های اولیهای هستند که توانائی تبدیل و تمایز به انواع مختلف سلولهای انسانی را دارند و از آنها میتوان در تولید سلولها و نهایتا بافتهای مختلف در بدن انسان استفاده کرد .
منابع اصلی سلولهای بنیادی شامل : مغز استخوان، بند ناف و جفت میباشد . امروزه استفاده از این سلولها جهت ترمیم بافتهای آسیب دیده انسانی در حال گسترش است .
جالب اینکه سلولهای بنیادی چند پتانسیلی هستند یعنی قابلیت تبدیل به بافتهای مختلف را دارند اعم از بافت عصبی ؛ عضلانی ؛ پوششی و غیره. که این توانائی محور اصلی توجه به سلولهای بنیادی است.
مزیت اصلی سلولهای بنیادی بند ناف این است که بسیار اولیه
بوده و توان تمایز بالایی دارند.همچنین سلولهای مشتق از مغز استخوان (
BMSCs ) توان تمایز بالایی دارند.
کاربردهای سلولهای بنیادی
- بیماران قلبی:
توصیه میشود برای افرادی که در مراحل وخیم بیماری قلبی بوده و در انتظار دریافت قلب پیوندی بهسر میبرند، در کنار تجویز داروهای سرکوبکننده سیستم ایمنی، از روش پیوند سلولهای بندناف بهعنوان یک روش کمکی استفاده کرد. بر این اساس، این ایده در دنیا مطرح شده است که نمونه
- بیماران کبدی:
پیوند سلولهای بنیادی علاوه بر بیماران قلبی در سایر بیماران نیز نتایج خوبی را نشان داده است. برای مثال، در حال حاضر اگر بیماری دچار سرطان کبد باشد، جراح مجبور است برای جلوگیری از انتشار سرطان (متاستاز) به بخشهای دیگر بدن، بخش سرطانی کبد را نابود کند. برای این منظور معمولاً طی دو عمل جراحی همزمان، خون ناحیه سرطانی کبد را قطع میکنند تا بافت* استفاده سلول های بنیادی در cloning :
یک دودمان سلول بنیادی جمعیتی از سلول ها است که مستمرا تقسیم شده و از بافت های انسان یا دیگر موجودات بدست می آید . محققین برای اهداف درمانی و پژوهشی از سلول های بنیادی جنینی و بالغ استفاده می کنند . Totipotent: این سلول ها توانایی تولید تمام سلول های مورد نیاز یک موجود زنده را داشته و عاقبت آنها مشخص نیست و بر اساس نیاز ، توانایی تبدیل شدن به هر دارند. 3- تماس سلول- سلول باعث متعهد بودن یک سلول بنیادین در لانه گزینی و رشد و تکثیر آن می مامع بیان ژن می گردد. تحت شرایط نوترکیبی به واسطه cre توالی خاتمه خارج شده و بیان ژن دوباره فعال می گردد. مدل سازی بیماری ها: توانایی ایجاد جهش های جایگاه خاص و ناک اوت کامل ژنها توسط gene targeting منجر به تولید موشهای مدل برای انواع بیماری ها از جمله بیماریهای عصبی و متابولیک و خونی شده است. یک مثال مربوط به آلزایمر می باشد که حداقل بر اثر جهش در 4 ژن ایجاد می شود . افزایش دز ژن و جهش در پروتئین پیش ساز بتا آمیلوئید (APP) با آلزایمر در ارتباط بوده جهش در زن آپولیپوپروتئین E نیز با ریسک افزایش یافته و کاهش سن شروع بیماری در ارتباط است. امروزه توسط gene targeting در سلول هایES مدل های موشی ایجاد شده اند که حاوی یک جهش نقطه ای در ژن APP و یا ژن ApoE ناک اوت شده می باشند. به کمک BAC و یستم های نوترکیبی جایگاه خاص مثل cre/Lox P مدل هایی برای جابه جایی های کروموزومی برای سرطانهای خاص ایجاد کرده اند. رد یابی دودمانها :همانطور که ذکر شد یک استفاده تکنولوزیgene targetiung قرار دادن یک ژن گزارشگر تحت کنترل یک پروموتر اندوژن برای مطالعه الگوی بیان ان ژن می باشد(knock in) . به کمک این تکنیک امکان رد یابی دودمانها یا انجام fate mapping توسط دستکاری ژنتیکی را فراهم آورده است . در این سیستم یک ریکامبیناز جایگاه خاص مثل cre تحت کنترل پروموتر خاصی در دودمان یا cell type خاصی قرار می گیرد. موشهای تهیه شده توسط این سلول های ES می توانند با موش های دارای یک ژن گزارشگر همراه با یک توالی خاتمه کراس داده شوند. بیان cre در سلول های خاص دودمان که بر اثر نوترکیبی بین جایگاههای LoxP ، برداشت توالی خاتمه و بیان ژن گزارشگر می باشد ، انجام می گیرد . بنابر این تمام اولاد سلول های اولیه بیان کننده cre با ژن گزارشگر نشاندار می شوند . بدین ترتیب می توان سرنوشت اخلاف سلول های مختلف را طی تکوین دنبال نمود
سلول های جنین های کلون شده موقعیت جدیدی برای مطالعه بیماری هایی که ژن آنها شناخته نشده است ایجاد می کند . بیماری motor neuron disease(بیماری نورون های حرکتی ) یکی از این موارد است . تخریب نورون های حرکتی علت عمده این بیماری کشنده می باشد اما علت دقیق بیماری به درستی شناخته نشده است . چندین فاکتور ژنتیکی و محیطی به نظر می رسد که در این بیماری نقس داشته باشند گرچه علت تخریب نورون ها شناخته نشده است . اکثر موارد این بیماری sporadic می باشند اما 5-10 % وراثتی اند . در میان این موارد خانوادگی جهش های ژن سوپر اکسید دیس موتاز (SOD 1) مسئول تقریباً 20 % موارد می باشد و آنالیز ژنتیکی نشان می دهد که حداقل 4 ژن دیگر هنوز در رابطه با این بیماری شناخته نشده اند . در ابتدا گمان می رفت که علت این بیماری کاهش عملکرد ژن باشد اما این گمان به نظر نمی آید که صحیح باشد . موش هایی که در آنها ژن SOD 1 اندوژن حذف شده دچار بیماری نورون های حرکتی نمی شوند در حالی که موش هایی که اشکال موتان ژن انسانی را بیان می کنند دچار فلج می گردند . چون موش ترانس ژنی که ژن انسانی را حمل می کند دو نسخه ژن خودش را نیز دار است ، این مشاهده نشان می دهد که تأثیر جهش به خاطر اثر سیتوتوکسیک یک پروتئین غیر طبیعی است و نه به خاطر نبود عملکرد پروتئین . چندین منبع سلولی جدید دارای بیماری وجود دارد که آشکار می کنند این پروتئین چگونه باعث تخریب نورون ها می شود . اگر غربال ژنتیکی پیش از کاشت جنین در مورد مواردی که موتاسیون ها شناخته شده اند انجام گیرد ، سلول های بنیادی جنینی حاوی جهش را می توان از جنین بدست آورد . متناوبا ، جهش های شناخته شده را می توان به سلول های بنیادی جنین وارد کرد (جنینی که فاقد بیماری است) . در نتیجه سلول های دارای بیماری نورون های حرکتی با دودمان اولیه متفاوت خواهند بود . هر چند این روش ها فقط در مواردی در دسترس می باشند که جهش شناخته شده باشد (تقریباً 2% موارد ) . در 8 % از موارد ، حالت بیماری وراثتی است اما ژن آن کشف نشده است و SCNT در این موارد فرصت های جدیدی ایجاد می کند . روش های مختلفی برای استخراج انواع سلول های خاص از دودمانهای سلول های بنیادی ابداع شده ، گرچه در اکثر موارد هنوز عملکرد نرمال آنها پس از انتقال به بدن تائید نشده است . در هر رژیم درمانی ، باید از دفع ایمنولوژیکی سلول های پیوند شده جلوگیری کرد اما پاسخ ایمنی احتمالاً در بیماری های مختلف متفاوت است . سلول های جنین های کلون شده ، در شرایطی مثل بیماری های قلبی عروقی که در انها دفع ایمنی می تواند توسط پیوند سلول های سازگار از نظر ایمونولوژی جلوگیری شود ، بسیار با ارزش است . بیماری های دیگری که به عنوان کاندیدا های مناسبی برای سلول درمانی می باشند بیماری های خود ایمنی شامل دیابت نوع 1 می باشند . در مورد این بیماری ها انتقال سلول های مشابه ار نظر ایمنی به فرد بیمار ، موجب دفع سلول ها می گردد . سلول های بنیادی ، سلول هایی هستند که واقعا می توانند به هر کدام از 200 نوع سلول بدن انسان تبدیل شوند . برای انجام این نوع درمان دو چالش در پیش رو وجود دارد : 1- وادار کردن سلول های بنیادی به تبدیل شدن به سلول مورد نظر 2- وادار کردن بدن به پذیرفتن آنها . اولین مشکل در مورد استفاده از سلول های بنیادی منبع به دست آوردن آنها است . هر کسی دارای سلول های بنیادی می باشد ، مثلاً در مغز استخوان ، اما در کودکان و بالغین این سلول ها قبلا کمی تخصصی شده اند . بسیاری از محققین شک دارند که آیا این سلول ها می توانند به انواع سلول های مورد نیاز تبدیل شوند یا خیر . بنابراین در انجام تحقیقات و معالجات از سلول های بنیادی جنینی استفاده می شود که هنوز تخصصی نشده اند . امروزه اکثر سلول های بنیادی را از جنین های IVF و یا سقط شده به دست می آورند . در مورد IVF ، یک جنین 5 روزه –بلاستولا – در رحم یک زن کاشته می شود و 9 ماه بعد یک نوزاد متولد خواهد شد . جنین های اضافی برای موارد عدم موفقیت یا حاملگی های بعدی نگه دارای می شوند . برای تهیه سلول های بنیادی های جنینی برای تحقیق ، بعضی از سلول های بلاستولا های اضافی را خارج می کنند و در ظروف مجزا برای رشد ، کشت می دهند . برای تبدیل این سلول ها به دودمانهای سلولی بنیادی دائمی ( دارای عمر طولانی ) سلول ها با فاکتور های رشد خاصی تغذیه می شوند . بلاستولا ها در این عملیات از بین خواهند رفت . در دیابت نوع 1 ، به کمک تولید سلول های پانکراس به دنبال روشی برای جایگزین کردن سلول های سازنده انسولین از دست رفته می گردیم . هدف از این نوع درمان جلوگیری از تزریق دائم انسولین و جلوگیری از مشکلاتی است که بعدا زندگی بیماران را تهدید می کنند . در یکی از تحقیقات سلول های بنیادی جنینی موش را وادار به تبدیل شدن به سلول های تولید کننده انسولین کرده اند اما از این سلول ها نمی توان برای انسان استفاده کرد . در یک سری آزمایشات که در اسرائیل انجام گرفته اند توانسته اند به موش هایی که سیستم ایمنی انها توسط دستکاری ژنتیکی مهار شده ، سلول های بتای کلون شده پانکراس را پیوند دهند ، ولی در انسان نمی توان این کار را انجام داد و همچنین یکی از اهداف این نوع درمان جلوگیری از رد پیوند است زیرا دارو های سرکوبگر ایمنی اثرات نامطلوبی مثل ناهنجاری کلیوی و افزایش خطر ابتلا به سرطان را ایجاد می کنند . در یکی از پژوهش ها تلاش شده تا سلول های بنیادی را در حالی که توسط کپسولی احاطه شده اند به بدن وارد کنند تا مانع دفع ایمنی گردند . در درمان به کمک سلول های بنیادی برای جلوگیری از دفع بافت از هسته سلول های فرد بیمار استفاده می شود . دانشمندی به نام Skorecki در صدد است تا شکل تغییر یافته ای از این تکنیک را مورد استفاده قرار دهد و از ترکیب مهندسی ژنتیک و کلونینگ استفاده کند . او معتقد است که انجام therapeutic cloning برای هر بیمار به کمک سلول های خودی بسیار گران و غیر عملی است . در این روش قرار است سلول های بنیادی بالغ کلون شده را طوری تغییر ژنتیکی دهند که توسط سیستم ایمنی دفع نگردند و برای درمان هر بیماری می توان از این سلول ها استفاده کرد . تا کنون توانسته اند سلول های بنیادی انسان را به سلول های خون ، عصبی و سلول های بتای پانکراس تبدیل کنند . اما اگر بر مشکل دفع پیوند هم غلبه شود سوالی که باقی می ماند این است که آیا سلول های پیوند شده در بدن عملکرد نرمال خواهند داشت یا نه ؟ مثلاً در این مورد در استرالیا سلول های عصبی تولید شده اند و به مغز نوزاد موش پیوند شده اند و عملکرد طبیعی داشته اند . اما هنوز هم قطعیت این موضوع در انسان و یا بیماری های دیگر مشخص نشده است . یکی از کاربرد هایSCNT جلوگیری از انتقال بیماری از والدین به نسل بعد می باشد ( بیماری هایی که بر اثر جهش یا ناهنجاری ژنوم هسته ای نمی باشند مثلاً بیماری های میتوکندریایی) . میتوکندری های اسپرم به فرزند منتقل نمی شوند بنابراین بیماری های میتوکندریایی فقط از مادر به فرزند منتقل می شوند . برای جلوگیری از این بیماری ها می توان هسته یکی از سلول های یک جنین مبتلا به بیماری میتوکندریایی را خارج کرده و به سیتوپلاسم یک تخمک سالم منتقل کرد و این تخمک سالم را در رحم مادر کاشت. در یکی از آزمایشات انجام شده ، سلول های بنیادی جنینی به مغز موشهای تازه متولد شده ای که از بیماری مشابه با multiple sclerosis رنج می بردند تزریق شدند . این موشها فاقد سلول های تولید کننده غلاف میلین بودند. سلول های تزریق شده به تمام مناطق مغز این موشها مهاجرت کرده و خود را به انواع سلول های از دست رفته تبدیل کردند و با جایگزین شدن سلول های تولید کننده غلاف میلین ، روند بیماری متوقف شد و بسیاری از موش ها به طور کامل بهبود یافتند . با دستکاری ژنتیکی در سلول های بنیادی می توان سلول های مقاوم به عوامل سرطان زا ، عوامل دارویی و ....... را انتخاب و جدا سازی نمود . به طوری که با وارد کردن ژن متیل گوانین متیل ترانسفر از (دارای نقش در ترمیم DNA) در سلول های بنیادی ، این سلول ها در in vitro به اثرات سمیت سلولی و ژنتیکی مواد سمی مانند Bis Cloro-ethyl nitrosurea (BCNU) و O4 Benzyl Guanin (O4BG) مقاوم شده و سپس با وارد کردن این سلول ها به موجود زنده و تیمار آن با این دارو ها سایر سلول ها حذف و سلول های مقاوم به این مواد شیمیایی انتخاب و تکثیر می شوند. سلولهای بنیادی پوششی بالغ در بین کراتینو سیت های غشاء پایه پوست دیده می شوند . این سلول ها باعث تولید سلول های جدید جهت ترمیم بافت سطحی پوست می شوند. سلول های بنیادی پوششی در تولید بافت پوست تولید شده به روش مهندسی بافت کاربرد داشته و این فرآورده ها امروزه کاربرد های کلینیکی متفاوتی از قبیل بانک پوست ، ترمیم سوختگی ها و ...... دارند. همچنین سلول های بنیادی پوست باعث تولید پوشت مصنوعی و پیوندی جهت درمان زخم ها و بیماری هایی از قبیل vitteligo می شوند.
سلولهای منفرد،پس از اندک زمانی شروع به تقسیم شدن پیاپی و مکررمی کند وسرانجام یک رویان ابتدایی (embryo)پدید می آورد. رویان ابتدایی،در ظرف چند روز به شکل خوشه ای از سلول در می آید که دانشمندان آنها را«سلولهای بنیادی ((embryonic stem cells(ESC)»،می نامند. این سلولهای بنیادی، خاستگاه همه سلولهای تخصص یافته(specialized) بدن فرد به شمار می آیند.
سلولهای بنیادی رویانی،تنها در رویانهای ابتدایی وجود دارند. در پیکر کودکان و بزرگسالان نیز سلولهای بنیادی یافت می شوند،اما از نوع دیگری هستند و آنها را«سلولهای بنیادی بالغ (adult stem cells(AS))»می نامند.
معمولا برای دستیابی به سلولهای بنیادی رویانی باید رویان (جنین) را متلاشی کرد.
یکی از دانشمندانی که درباره سلولهای رویانی پژوهش می کند،آنها را؛«سلولهای نوزادی که هنوز حرفه ای را انتخاب نکرده اند»،نامیده است. سلولهای بنیادی را بر مبنای کاری که می توانند انجام دهند،توصیف می کنند،نه از روی ریختشان. نخست،این سلولها هیچگونه تخصصی ندارند؛نمی توانند مو در بیاورند،یا غذا هضم کنند،یا پیامهای عصبی انتقال دهند. دوم، توانایی«انتخاب کردن حرفه ای»دارند. یعنی می توانند به سلولهای گوناگون تبدیل شوند. مثلا،سلولهای بنیادی آدمی،می توانند بیش از 200 نوع سلول تخصص یافته،از جمله سلولهای پوست،خون،استخوان،ماهیچه ای و عصبی،تولید کنند. سوم، سلولهای بنیادی می توانند خود را،در طول زمان زیادی،با تقسیم سلولی پیاپی از نو بسازند. یعنی می توانند نسخه های دقیق و مکرری از خود،به طور متوالی تولید کنند،تا وقتی که عاملی آنها را برای متمایز شدن برانگیزد.
نخستین باری که دانشمندان،به وجود سلولهای بنیادی گمان بردند،در اوایل قرن20وهنگامی بود که نمو رویان های ابتدایی را مورد بررسی قرار می دادند.
نخستین تایید وجود سلولهای بنیادی،در اوایل دهه1960، حاصل آمد.جیمزتل((Till, J.و ارنست مک کلوخMcCulloch, E.)) در بنیاد سرطان اونتاریو،در تورنتو کانادا،چگونگی تخریب سلولهای خون موش های آزمایشگاهی را به وسیله تابش،بررسی می کردند. آنان دریافتند که می توانند با تزریق سلولهای مغز استخوان موش های دیگر دارای ژنتیک مشابه،به موش های مورد آزمایش،مقدار لازم سلولهای خون این موشها را تامین کنند و مانع مرگ آنها شوند.
تل و مک کلوخ،کمتر از دو هفته پس از تزریق سلولهای مغز استخوان،به موش های پذیرنده،مغز استخوان و طحال این موش ها را آزمایش کردند. این دو پژوهشگر چند مجموعه کلون (Clone) از سلولهای خون پیدا کردند. آنان انتظار داشتند که در هر مجموعه فقط یک نوع سلول خون پیدا کنند. اما،مشاهده کردند،که هر مجموعه کلون محتوی همه انواع سلولهای خون است و همه آنها فقط از یک سلول مغز استخوان پدید آمده اند. بنابراین،به گفته مک کلوخ«برای نخستین بار ثابت می شد که چیزی از قبیل سلول بنیادی،وجود دارد.»
تاریخچه پژوهش درباره سلول های بنیادی،نشان می دهد که شناسایی این سلولها کار ساده ای نیست. سلولهای بنیادی،برخلاف سلولهای عصبی،سلولهای خون و دیگر سلولهای بالغ،ظاهر مشخصی ندارند. بنابراین پژوهشگران،سلولهای بنیادی را بر اساس توانایی هایی که دارند توصیف می کنند،نه از روی ریخت و اندازه آنها. پژوهشگران،سلولهایی را که کشت(رشد)می دهند، همواره آزمایش می کنند تا ببینند آیا این سلولها،ویژگی هایی را که باید،نشان می دهند یا نه.
سلولهای بنیادی رویانی را که از رویان ابتدایی جدا می کنند و در محیط کشت آزمایشگاهی کشت می دهند،ویژگی بسیار مهمی دارند:می توانند در طی زمان طولانی همواره تقسیم و در نتیجه تجدید شوند. این سلولها در شرایط مناسب،پی در پی تقسیم می شوند و سلولهای رویانی دیگری را تولید کنند.
در سالهای اخیر،دانشمندان پرشماری سلولهای بنیادی را کانون پژوهش های خود ساخته اند. توجه کم نظیر به سلولهای بنیادی، سه علت اصلی دارد:ارزش آنها برای پژوهش های پایه،دورنمای استفاده از آنها برای درمان بیماری و آسیب دیدگی،و امکان به کارگیری آنها در تولید داروهای جدید.
دانشمندان بسیاری عقیده دارند که سلولهای بنیادی به نیاز موجود برای دارو و درمان های جدیدی که ممکن است رنج آدمی را کم کنند،پاسخ خواهند داد.
اغلب سلولهای بدن انسان عملا قادر به تقسیم نیستند و
بسیاری از زمان تولد تا مرگ شخص بدون تقسیم شدن حضور دارند.
البته بعضی بافتهای بدن نظیر خون، پوست و لوله گوارش دارای چرخه بازسازی سریعی هستند و در هر روز ممکن است چندین سلول جدید بسازند. به عنوان مثال یک مرد متوسط با وزن 70 کیلوگرم در هر روز 1011×2 سلول خونی می سازد. همچنین روزانه میلیونها سلول پوستی و گوارشی ساخته می شود. سلولهای بنیادی سلولهایی هستند که قادر به همانندسازی خود هستند و نیز می توانند طی فرایند تمایز به یک یا انواعی از سلولهای بالغ تبدیل شوند.
به طور کلی سلولهای بنیادی به سه دسته تقسیم میشوند:
- سلولهای بنیادی بزرگسال (Adult stem cells)،
- سلولهای بنیادی جنینی (Embryonic stem cells)
- سلولهای بنیادی بند ناف (Umbilical cord stem cells).
سلولهای بنیادی بزرگسال مانند همه سلولهای بنیادی دیگر دو ویژگی مشترک دارند؛ اول اینکه قادر به ساخت کپی های خود به مدت طولانی می باشند و دوم اینکه می توانند به سلولهای بالغی با خصوصیات مورفولوژیک شناخته شده و با عملکرد اختصاصی تبدیل شوند.
ین سلولها قادر نیستند به همه نوع سلول تمایز پیدا کنند بلکه تنها قادرند به سلولهای بالغ همان بافتی که در آن هستند تبدیل شوند (مثلا سلولهای بنیادی مغز استخوان که به سلولهای خونی تبدیل می شوند). سلولهای بنیادی بزرگسال بسیار کم و نادر هستند به عنوان مثال از هر 10 تا 15 هزار سلول مغز استخوان تنها یک سلول از نوع سلولهای بنیادی است. منشا و چگونگی شکل گیری این سلولها به طور دقیق مشخص نیست و فرضیات مختلفی برای آن مطرح شده است از جمله اینکه این سلولها در هنگام تمایز جدا از بقیه مانده و تمایز نیافته اند. امروزه سلولهای بنیادی از بافتهای مختلفی از جمله خون، مغز، نخاع، لوله گوارش، پوست، عضلات و غیره جدا شدهاند.
نام سلولهای بنیادی جنینی (رویانی) از منشا آنها یعنی رویان گرفته شده است. در واقع این سلولها از یکی از مراحل ابتدایی تشکیل و توسعه جنین بنام مرحله بلاستوسیتی گرفته می شوند. به طور اختصاصی سلولهای بنیادی جنینی از توده سلولی درونی بلاستوسیت در مرحله پیش از لانه گزینی در دیواره رحم به دست می آیند. این سلولها هم قادر به همانندسازی خود هستند و هم قادرند به انواعی از سلولهای مختلف تمایز یابند.
دسته سوم سلولهای بنیادی سلولهای بند ناف هستند که همانطور که از نامشان بر می آید از خون بند ناف در هنگام وضع حمل جدا می شوند و قابل نگهداری هستند تا در آینده در صورت لزوم برای همان بچه یا اعضای خانواده وی و یا برای شخص دیگری استفاده شوند.
امروزه محققان در حال بررسی و آزمایش امکان کاربرد سلولهای بنیادی در درمان بیماریهای مختلف می باشند. از جمله بیماریهایی را که امیدهای زیادی به درمان آنها می رود می توان به آلزایمر و پارکینسون، آسیبهای نخاعی، دیابتها (از طریق جایگزین نمودن سلولهای پانکراتیک ترشح کننده انسولین)، بیماریهای کرونری قلب (با جایگزینی سلولهای ماهیچه ای قلب)، بیماریهای کبدی مثل سیروز و غیره اشاره نمود.
سلول های بنیادی قادر به ایجاد هر نوع سلولی در بدن هستند.
آنها می توانند تحت تأثیر بعضی شرایط فیزیولوژیک یا آزمایشگاهی به سلول
هایی با عملکردهای اختصاصی مانند سلول های عضلانی قلب یا سلول های
تولیدکننده انسولین در پانکراس و... تبدیل شوند.
تحقیقات در زمینه سلول
های بنیادی دو ویژگی مهم دارند که آنها را از انواع سلول های دیگر متمایز
می سازد:
۱- توان نوسازی سلول های نامتمایزی هستند که توانایی تکثیر
نامحدود خود را دارند و در حالت نامتمایز باقی بمانند.
۲- پرتوانی:سلول
های بنیادی قادر به ایجاد هر نوع سلولی در بدن هستند. آنها می توانند تحت
تأثیر بعضی شرایط فیزیولوژیک یا آزمایشگاهی به سلول هایی با عملکردهای
اختصاصی مانند سلول های عضلانی قلب یا سلول های تولیدکننده انسولین در
پانکراس و... تبدیل شوند.
دانشمندان در ابتدا با دو نوع از سلول های
بنیادی که از حیوانات و انسان ها به دست آمده بودند، شامل سلول های بنیادی
جنینی و سلول های بنیادی بالغین کار می کردند که این دو دسته سلولی
عملکردها و ویژگی های مختلفی دارا هستند.
بیشتر از ۲۰ سال قبل دانشمندان
توانستند سلول های بنیادی را از جنین ابتدایی موش جدا کنند و با مطالعه
سالها جزئیات بیولوژی سلول های بنیادی موش؛ در سال ۱۹۹۸ دانشمندان موفق به
جدا کردن سلول های بنیادی جنینی از جنین انسان و رشد آنها در محیط
آزمایشگاه شدند و این سلول ها را سلول های بنیادی جنینی انسان نامیدند. این
سلول های همانطور که از نامشان مشخص است از جنین های ۴ یا پنج روزه که از
تخم های آزمایشگاهی بارور می شوند به دست می آیند و در محیط آزمایشگاهی در
محیط کشت های اختصاصی رشد داده می شوند.
سلول های بنیادی بالغین، سلول
های نامتمایزی هستند که در بین سلول های تمایز یافته بافت ها و ارگان های
بدن انسان یافته می شوند و توانایی نوسازی و تمایز به انواع سلول های
اختصاصی اصلی بافت یا ارگان را دارند. نقش های اولیه این سلول ها در یک
ارگان زنده شامل حمایت کردن و تعمیر بافت هایی است که از آنها به دست می
آیند.
دانشمندان سلول های بنیادی بالغین را در بافت های بیشتری نسبت به
آنچه فکر می کردند به دست آوردند. این یافته ها دانشمندان را به استفاده از
این سلول ها در علم پیوند راهنمایی کرد. اکنون بیشتر از ۳۰ سال از استفاده
سلول های بنیادی بالغین خون ساز که از مغز استخوان برای پیوند جدا می
شوند، می گذرد.
در سال ۱۹۶۰ محققان کشف کردند که مغز استخوان حداقل دو
نوع سلول بنیادی را دربردارد که شامل سلول های بنیادی خون ساز که انواع
سلول های خونی را در بدن می سازند و سلول های استرومال که می توانند بافت
های غضروف، استخوان، چربی، بافت های همبندی فیبروز را در بدن بسازند، است.
در
سال ۱۹۶۰ دانشمندانی که موش ها را مطالعه می کردند دو منطقه از مغز موش را
که شامل سلول های تقسیم شونده که تبدیل به سلول های عصبی می شوند، کشف
کردند. بر خلاف این گزارش ها بیشتر دانشمندان معتقد بودند که سلول های عصبی
جدید در مغز بالغین نمی تواند تولید شود تا اینکه در سال ۱۹۹۰ دانشمندان
توافق کردند که مغز بالغین شامل سلول های بنیادی است که توانایی تولید سه
نوع اصلی سلول های مغزی را که شامل آستروسیت ها و الیگودندروسیت ها (سلول
های غیرعصبی) و نورون ها (سلول های عصبی) دارا هستند.
سلول های بنیادی
بالغین در ارگان ها و بافت های زیادی از بدن جدا شده اند، اما نکته مهم این
است که تعداد بسیار محدودی از این سلول ها در هر بافت وجود دارد که در
منطقه خاصی از آن بافت برای سالها ساکن می مانند، تا اینکه با ظهور بیماری
یا آسیب بافتی فعال می شوند.
بافت هایی که سلول های بنیادی بالغین در
آنها یافت می شوند عبارتند از: مغز استخوان، خون محیطی، مغز، عروق خونی،
پالپ دندان، عضله اسکلتی، پوست، کبد، پانکراس، قرنیه، شبکیه، سیستم گوارش.
دانشمندان
در خیلی از آزمایشگاه ها تلاش می کنند تا بتوانند که سلول های بنیادی
بالغین را در کشت سلول به انواع سلول ها اختصاصی تبدیل کنند تا از آنها
برای درمان بیماری ها و صدمات بافتی استفاده کنند.
پتانسیل های درمانی
این سلول ها عبارتند از: جایگزینی سلول های تولیدکننده دوپامین در مغز در
بیماری پارکینسون، تولید سلول های انسولین ساز برای نوع یک دیابت (وابسته
به انسولین) و تعمیر سلول های عضلانی تخریب شده.
سلول های بنیادی بند
ناف از سلول های پرتوان دیگر هستند که همچون سلول های بنیادی بالغین قادرند
تا انواعی از سلول ها را در محیط آزمایشگاهی تولید کنند. در بند ناف دو
دسته سلول های بنیادی وجود دارند که قادر به ساختن سلول های خونی و سلول
های استخوانی و چربی بوده و همچنین به عنوان جایگزینی برای سلول های مغز
استخوان در علم پیوند مغز استخوان محسوب می شوند.
●ضرورت تحقیق و پژوهش
در خصوص سلول های بنیادی چیست؟
سلول های بنیادی قادرند به طور نامحدود
هر نوع سلول را به وجود آورند که این خصوصیت باعث استفاده حیرت آور این
سلول ها در علم پیوند شده است. علاوه بر این می توان به گونه ای این سلول
ها را از نظر ژنتیکی تغییر داد تا پس از پیوند دفع نشوند. کارهایی که در
این رابطه تا به حال انجام شده اند عبارتند از:
۱- سلول های ماهیچه قلب
توان تکثیر طی دوره بزرگسالی را ندارند و هرگاه با جراحت یا ایسکمی، به
بافت مزبور آسیبی برسد بافت غیرفعال جایگزین سلول های ماهیچه ای قلب فعال
می شوند. سلول های بنیادی جنینی توان تبدیل به سلول های ماهیچه ای قلب را
دارند که از آنها می توان در درمان موارد سکته های قلبی که عامل اصلی آسیب
به ماهیچه قلب هستند و همچنین در موارد اختلالات مادرزادی قلبی استفاده
کرد.
۲- سلول های بنیادی خون ساز در علم پیوند مغز استخوان برای درمان
بعضی بیماری های خونی مانند تالاسمی و همچنین سرطان های افراد بزرگسال و
خردسال به کار می روند .
۳- سلول های مولد انسولین از سلول های بنیادی
جنینی موش و انسان به دست آمده اند که می توانند راهگشایی در درمان بیماری
دیابت باشند.
۴- سلول های عصبی از سلول های بنیادی جنینی به دست آمده
اند که از آنها می توان در درمان بیماری های تخریب شونده سیستم عصبی مانند
پارکینسون و یا آلزایمر استفاده کرد.
۵- سلول های پوستی از سلول های
بنیادی جنینی به دست آمده اند که از این سلول ها می توان در درمان سوختگی
ها و بهبود زخم ها استفاده کرد.
۶- تبدیل سلول بنیادی به سلول های
سازنده غضروف و استخوان
۷- تبدیل سلول بنیادی به سلول کبدی
۸- تولید
لوله گوا رش از سلول های بنیادی
درباره سلول بنیادی
سلولهای بنیادی دارای دو ویژگی اساسی یعنی توانایی تقسیم شدن و تولید سلولهایی با خواص یکسان و ایجاد انواع سلولهای تمایز یافته هستند. براساس توان تمایزی، سلولها را میتوان به انواع ذیل تقسیم کرد:
- 1) سلولهای همه توان: این سلولها میتوانند همه سلولها اعم از سلولهای فرد و سلولهای برون جنینی (جفت) را بسازند مانند سلول تخم و یا هریک از سلولهای یک جنین دو سلولی که هر سلول آن میتواند یک فرد کامل را بسازد.
- 2) سلولهای پرتوان: سلولهایی هستند که میتواند غالب یا همه سلولهای فرد را بسازند. مثلا سلولهای بنیادی جنینی تحت شرایط خاص میتوانند یک فرد را بسازند ولی قادر به ایجاد سلولهای برون جنینی (جفت) نیستند. سلولهایی که از گنادهای جنینی بدست میآیند و به آن سلولهای زاینده جنینی گفته میشود نیز جز این دسته هستند. سلولهای تمایز نیافته سرطان جنینی مشتق از تراتوکارسینوما نیز پرتوان هستند. تراتوکارسینوما، تومورهای تمایز یافته خوشخیم هستند که دارای جمعیتهای تمایز نیافته زیادی هستند.
- 3) سلولهای چند توان: تعداد محدودتری از انواع سلولی را میتوانند ایجاد کنند. مانند سلولهای بنیادی واقع در بافتهای بزرگسالان
سلولهای بنیادی با دو ویژگی زیستی، توان نوسازی و قدرت تمایز، توجه محققان را در استفاده از آنها در طب ترمیمی و درمان بدخیمیها به خود جلب کرده است. به عنوان مثال مغز انسان حاوی سلولهای بنیادی عصبی نادری است که در شرایط خاص میتوان آنها را کشت و افزایش داد. ضمن آنکه میتوان با استفاده از ریزمحیطهای خاصی آنها را به طرف سلولهای مورد نظر تمایز داد.
به طور کلی سلولهای بنیادی دارای
دو منشاء جنینی و بزرگسالان هستند. سلولهای
بنیادی جنینی از توده سلولی داخلی جنین در مرحله بلاستوسیست به
دست
میآیند. دسته دیگر، سلولهای بنیادی بزرگسالان
هستند که در بسیاری از بافتهای تخصص یافته
بدن از جمله مغز، مغز استخوان، کبد، پوست، لوله گوارش، قرنیه و
شبکیه چشم و حتی
پالپ عاج دندان یافت میشونـد.
سلولهای
بنیادی جنینی از جنین اولیه حاصل
میشود و توانایی ساخت تمام اعضا یک موجود زنده را دارند. از آنجا که
سلولهای بنیادی جنینی نامیرا هستند، دانشمندان در تلاشند تا با مداخله و
دستکاری
ژنهای مؤثر در پیوند و فاکتورهای سازگاری بافتی آنها، رده سلولی فراگیر
تولید کنند. به عبارت دیگر با
حذف ژنهای سازگاری بافتی در
سلولهای بنیادی جنینی، سلولهایی تولید کنند که قابلیت پیوند به تمام
افراد را
داشته باشد. اگر بتوان چنین سلولهایی را تولید کرد، به علت نامیرا بودن
آنها، منبع لایزالی از سلولهای یفراگیر
خواهیم داشت که بهطور نامحدود قابلیت نگهداری، تکثیر و پیوند را دارا است و
از
این راه مشکل پسزدگی پیوند حل خواهد شد.
سلولهای بنیادی خون بند ناف: درخون بند ناف دو دسته سلول بنیادی خونساز و مزانشیمی وجود دارد. عدم بیان آنتیژنهای سازگار بافتی کلاس دو در سلولهای بنیادی خون بند ناف، این سلولها را جزو کاندیدهای مهم پیوند سلولهای بنیادی برای بسیاری از بیماریها به ویژه بیماریهای خونی قرار داده است. یکی از مشکلات بیماران در پیوند مغز استخوان پیدا کردن یک دهنده مناسب است که اغلب حتی در مراکز پیشرفته دنیا در 30درصد بیماران چنین شانسی وجود ندارد. از طرفی، اختلاف در جایگاه ژنهای مربوط به مولکولهای پروتئینی سازگاری بافتی در سلولهای مغز استخوان دهندگان بالغ باعث عوارض کشنده ناشی از بیماری علیه میزبان در گیرنده میگردد و عملا در مواقعی که فرد کاملا مشابه وجود نداشته باشد، استفاده از سلولهای مغز استخوان افراد بالغ مقدور نخواهد بود. سلولهای بنیادی خون بند ناف با ویژگی که در بالا به آن اشاره شد به دو دلیل، اولا به خاطر در دسترستر بودن و ثانیا به دلیل قابل تحمل بودن آن توسط گیرنده، برای چنین بیمارانی بسیار مناسب هستند. از طرفی این سلولها منبع مناسبی برای سلولهای مزانشیمی نیز هستند و به خاطر نداشتن هیچ گونه عارضه برای دهنده، استفاده از آنها بسیار مورد توجه است.
این سلولها در اغلب اعضا یک فرد بالغ از جمله مغز استخوان به فراوانی وجود دارند و قابلیت تکثیر و تمایز در محیط آزمایشگاه را دارا هستند؛ هرچند تکثیر محدودی در آزمایشگاه دارند. از تمایز این سلولها، ردههای دیگری از سلولها نظیر سلولهای چربی، سلولهای استخوانی، غضروفی و یا حتی سلولهای قلبی و عصبی را میتوان تولید کرد. درکنار سلولهای جنینی، سلولهای بنیادی بزرگسالان هم از مزایایی برخوردارند. برای مثال، این سلولها کاندیدهای بسیار خوبی برای طب پیوند بهشمار میروند. در واقع میتوان سلولهای بنیادی را از مغز استخوان یک فرد گرفت و دوباره به بخش آسیبدیده بدن همان فرد پیوند زد. بنابراین چون این سلولها از خود فرد گرفته شدهاند، مشکل رد پیوند بهوجود نخواهد آمد
سلولهای بنیادی حاصل از برنامهریزی مجدد سلول: اگر دست و پای یک سمندر را قطع کنید، بعد از گذشت مدتی، اندامهای قطع شده ترمیم مییابند. دانشمندان عرصه سلولهای بنیادی و مهندسان بافتی، رویای تحقق یافتن چنین عملی را در انسان و سایر پستانداران درسردارند. این رویا با کشف چهار ژن که قادر بودند سلول پوستی را به سلول بنیادی تبدیل کنند، قدری به واقعیت نزدیکتر شده است. این یافتهها در تابستان 1386 توسط محققان ژاپنی دانشگاه کیوتو و دو گروه از محققان آمریکایی دانشگاه هاروارد و انیستیتو فناوری ماساچوست به صورت جداگانه با چاپ مقالاتی در نشریات علمی بسیار معتبر گزارش شد. این محققان موفق شدند سلولهای پوستی موش و به دنبال آن سلولهای پوستی انسان را با وارد کردن چهار ژن به سلول بنیادی جنینی القاء نمایند و سپس از آنها انواع سلولهای پرتوان القاء شده را بدست آورند. این عمل در انسان طی دو ماه اخیر گزارش شده است. به این فرآیند تولید سلول های بنیادی پرتوان القاء شده گفته می شود که نوعی بازبرنامه ریزی هسته سلول است.
- بیماریهای قلبیتوان سلولهای ماهیچهای قلب برای تکثیر طی دوره بزرگسالی بسیار اندک است و معمولا متعاقب یک سکته، جایگزینی سلولهای مرده با این روش مقدور نیست. بنابراین جراحت یا ایسکمی به وجود آمده منجر به تشکیل بافت اسکار غیر فعال، به جای سلولهای ماهیچهای قلبی فعال میشود که تحت عنوان بدشکلیهای عضله قلبی شناحته میشود. این بدشکلیها میتواند در طول زمان منجر به نارسایی مزمن قلبی گردد که از معضلات اصلی بهداشتی کشورهای غربی و توسعه یافته است. تنها در ایالات متحده حدود 1/7 میلیون نفر از سکته قلبی و 9/4 میلیون نفر نیز از نارسایی مزمن قلبی رنج میبرند. علاوه بر آن، نقصهای مادرزادی قلب، که عموما حاصل آسیب به ماهیچه یا دریچههای قلبی است حدود 5000000 امریکایی را متاثر کرده است و هرساله حدود 400000 نفر جدید با این نقص شناسایی میشوند. علیرغم پیشرفتهای اخیر در درمان بیماریهای قلبی میزان بروز، بستری و مرگ و میر ناشی از آن همچنان در حال افزایش است. بعد از تشخیص بیماری نارسایی قلب، از هر 5 بیمار یک نفر در طول 12 ماه جان خود را از دست میدهد. بنابراین، هرگونه تغییر هرچند کوچک در بهبود و افزایش طول عمر بیماران میتواند تاثیر بزرگی در ارتقاء سلامت جامعه داشته باشد. متخصصان امیدوارند سلولهای بنیادی را از مغز استخوان افراد بیمار (یا جنین نوظهور) استخراج و آنها را در محیط آزمایشگاه به سلولهای قلبی تبدیل کنند و نهایتا با تزریق این سلولهای تمایزیافته به بدن، امکان ترمیم بافتهای آسیبدیده قلب را فراهم آورند. استفاده از سلولهای خونساز مغز استخوان خودی به دلیل مشکلات اخلاقی و درمانی کمتر، بیش از سایر انواع سلولها مورد توجه قرار گرفته است و تا کنون بیش از 900 بیمار در دنیا بعد از ابتلا به بیماریهای قلبی از جمله سکته قلبی با استفاده از سلولهای بنیادی تحت درمان قرار گرفتهاند که نتایج اولیه ضمن تایید ایمن بودن آنها کارایی آنها را نیز در مطالعات بالینی فاز یک و دو تایید میکند. جداسازی سلولهای تک هستهای، سلولهای واجد CD34 و یا CD133 و همچنین استفاده از داروهایی که موجبات حرکت سلولهای بنیادی به خون محیطی را فراهم میکنند از مهمترین خط مشیهای مدنظر در این درمانها به شمار میرود.
- بیماری انسداد شریانهای محیطیبیماری انسداد شریانهای محیطی بیماری شایعی است که حدود 15% افراد بالای 50 سال را گرفتار میکند. اولین مرحله در پیدایش بیماری انسداد شریانهای محیطی، آسیب آندوتلیال شریانهای محیطی است. علاوه بر آن، آسیب اندوتلیال در پیشروی بیماری نقش بسیار مهمی دارد. اگر چه در مراحل اولیه این بیماری علایم بیماری به ندرت خود را نشان میدهد، اما با پیشرفت تدریجی بیماران غالبا محدودیت حرکت را تجربه میکنند و حتی در موارد شدید ممکن است کاملا قدرت حرکت خود را از دست بدهند. تحقیقات مختلف آزمایشگاهی و بالینی نشان دادهاند که سلولهای پیشساز آندوتلیال در پاسخ به ایسکمی، از مغز استخوان به بافت ایسکمیک مهاجرت و در روند تشکیل عروق جدید نقش اصلی را ایفا میکنند. این سلولهای پیشساز علاوه بر برخورداری از ویژگیهای سلولهای بنیادی قادر به ترشح فاکتورهای سازنده عروق نیز هستند. در نتیجه، این احتمال قویا مطرح میشود که کاشت این سلولها در مناطق ایسکمیک اندامها بتواند با فراهم آوردن سلولهای پیشساز آندوتلیال و فاکتورهای آنژیوژنیک در روند تشکیل عروق جدید موثر باشد. با وجود تحقیقات اندکی که در زمینه درمان بیماریهای عروقی به کمک سلولهای بنیادی صورت گرفته است، نتایج بسیار رضایت بخش بوده است. به نظر میرسد با به کارگیری این سلولها در درمان ایسکمی بیماران مبتلا به انسداد شریانهای محیطی بتوان علاوه بر جلوگیری از پیشروی بیماری در آنها، با تشکیل عروق جدید در درمان مشکلات آنها نیز موثر بود.
- بیماریهای
کبدسیروز کبدی مرحله انتهایی
فیبروز کبدی در زمینه آسیبهای مزمن کبدی با علل گوناگون است که در آن
ساختمان
طبیعی کبد تخریب شده و فیبروز پیشرفته همراه با ندولهای رژنراتیو تشکیل
میشود.
در بیماران سیروتیک زمانی که عملکرد کبدی در حدی مختل شود که نتواند
نیازهای فیزیولوژیک
بدن را تامین کند، عوارض سیروز ظاهر میشود و مرگ و میر به شدت بالا
میرود. در
مطالعات انجام شده میزان بقای یک ساله در سیروز جبران شده 100درصد و در
کلاس B 80%
درصد است، در حالی که این میزان در بیماران با کلاس C کمتر از 50 درصد است.
اگرچه در عده کمی از مبتلایان به سیروز، درمان موثر برعلیه عامل ایجاد
کننده اولیه
میتواند منجر به برگشت سیروز شود، در اغلب مبتلایان به سیروز جبران نشده
تنها
درمان نجاتبخش شناخته شده و موثر پیوند کبد است. با این حال پیوند کبد نیز
مشکلات
بسیاری به همراه دارد. اولا تعداد موارد پیوند کبد در مقایسه با بیماران
نیازمند
به پیوند کبد در تمام دنیا بسیار پایین است. ثانیا هزینههای پیوند کبد و
داروهای
ایمونوساپرسیو که پس از پیوند مورد نیاز هستند بسیار بالاست، به طوری که
اغلب
بیماران در کشور توانایی مالی این اقدام درمانی را ندارند. ثالثا عوارض جدی
و مهمی
(مانند پس زدن پیوند، عود بیماری اولیه در کبد پیوند شده، عوارض بیلیاری، و
عفونت
با میکروارگانیسم های فرصت طلب) ممکن است پس از پیوند کبد ایجاد شود که
مشکلات
فراوانی برای بیمار و تیم پزشکی ایجاد میکند.
نکات فوق موجب شده است تا نیاز بسیار زیادی در زمینه روشهای درمانی جدیدتر
جایگزین پیوند کبد برای مبتلایان به سیروز جبران نشده در دنیای پزشکی احساس
شود.
یکی از روشهایی که به صورت بالقوه میتواند جایگزین پیوند کبد شود، پیوند
سلولهای بنیادی مغز استخوان خود بیمار است. در مطالعات آزمایشگاهی اثبات
شده است
سلولهای بنیادی جنینی و همچنین سلولهای بنیادی بزرگسالان میتوانند به
سلولهای
کبدی تبدیل شوند. اکثر این تحقیقات پایه در 5 سال اخیر انجام شدهاند و
موضوع
تبدیل سلولهای بنیادی به سلولهای کبدی و در نهایت جایگزینی این سلولها و
تولید
بافت کبدی طبیعی از موضوعات روز هپاتولوژی است که در این زمینه تحقیقات
گستردهای
در دنیا انجام گرفته و میگیرد. در مطالعات حیوانی تزریق سلولهای بنیادی
جنینی
موجب بهبود آسیب کبدی در موش شده است. همچنین بر اساس این مطالعات تبدیل
سلولهای
مزانشیمال مغز استخوان به هپاتوسیتها و تزریق آنها به رتهای مبتلا به
سیروز،
بدون عارضه بوده و موجب بهبودی بیماری کبدی در رتها شده است.
در مطالعه دیگری که اخیرا صورت گرفته، سلولهای بنیادی را در محیط آزمایشگاهی به سلولهای کبدی تبدیل و به بیماران سیروزی تزریق کردهاند. نکته مهم در مطالعه مذکور این است که تزریق سلولهایی که خارج بدن انسان از سلول بنیادی به سلولهای کبدی تبدیل شده بودند بدون عارضه بوده است. -
بیماریهای پانکراس و دیابتدیابت ملیتوس را میتوان به دو گروه اصلی نوع 1 و نوع 2تقسیم کرد. در دیابت نوع 1 اختلال در سلولهای مولد انسولین با تخریب خود ایمن این سلولها آغاز میشود. این بیماران به تزریق روزانه انسولین نیاز دارند. هم اکنون قریب به 1/18 میلیون نفر در سراسر دنیا از این بیماری رنج میبرند و پیشبینی میشود این رقم تا سال 2010 به 7/23 میلیون نفر برسد. دیابت نوع 2 بیماری متابولیک پیچیدهای است که 95 درصد جمعیت بیماران دیابتی را تشکیل میدهد. هرچند کشف و تولید انسولین بسیاری از مشکلات این بیماران را مرتفع ساخته است ولی همچنان برای پیشگیری از عوارض بیماری لازم است که سطح انسولین با دقت بیشتری کنترل و نظارت شود. بنابراین ایجاد سلولهایی که خود قادر به تولید انسولین در مواجهه با افزایش قند خون باشند، از اهمیت بسزایی در درمان این بیماری و کاهش عوارض دیررس آن برخوردار است.
جایگزینی سلولهای بتای پانکراسی، هدف چندین دهه برای کاهش میزان مرگ و میر و پیشرفت بیماری دیابت بوده است. پیوند سلولهای بتای مولد انسولین به شکل پانکراس کامل یا جزایر لانگرهانس جدا شده، گزینه درمانی امیدوار کنندهای برای درمان این بیماری است. با این حال کمبود شدید بافتهای دهنده متناسب با گیرنده از مشکلات اساسی این روش درمانی محسوب میشود و تلاشهای تحقیقاتی زیادی برای تولید بافت تولید کننده انسولین جهت پیوند در مدلهای حیوانی و انسانی متمرکز شده است. یکی از این روشها تمایز سلولهای بنیادی و یا پیشساز بزرگسالان به سلولهای بتای پانکراس، مولد انسولین، است. استفاده از مهندسی بافت برای ایجاد این سلولها و استفاده از سلولهای بنیادی جنینی از سایر گزینههای مطرح در این زمینه به شمار میرود. استفاده از ایمونوتراپی با استفاده از سلولهای درگیر در سیستم ایمنی همانند سلولهای دندریتیک تمایز یافته از سلولهای بنیادی برای کاهش اثرات خود ایمنی در این بیماران به خصوص افراد مبتلا به دیابت نوع یک یکی از انواع درمانهای سلولی است که در این بیماران مورد توجه قرار گرفته است. اخیرا متخصصان دانشگاه آلبرتا در کانادا، موفق شدند سلولهای بنیادی مزانشیمی را به سلولهای پانکراس انسانی تبدیل و سپس به بیماران دیابتی منتقل کنند. -
بیماریهای کلیه و پیوند کلیهاز مشکلات عمده بیماران پیوند کلیه، رد پیوند کلیه است که به صورت حاد یا مزمن ظاهر میشود. یکیاز راهکارهای درمانی افزایش بقاء پیوند استفاده از داروهای سرکوبگر ایمنی است. مصرف داروهایسرکوبگر ایمنی ابتلا به عفونتهای فرصت طلب و بدخیمیها را افزایش میدهد و اثرات زیانباری را در کلیه پیوندی بر جای میگذارد. برای افزایش بقاء پیوند روشهای گوناگونی ارائه شده است. از آنجا که پیوند کلیه به مفهوم پیوند آلوگرافت است، لذا اهداف درمانی در پیوند بافتهای توپر بر القاء سطحی از تولرانس ایمونولوژیک اختصاصی ودائمی متمرکز شدهاند تا عاری از درمانهای طولانیمدت با داروهای سرکوبگر ایمنی باشد. مطالعات فراوانی پیرامون استفاده از سلولهای بنیادی خونساز فرد دهنده پیوند به منظور القاء تولرانس یاکایمریسم در گیرنده پیوند وجود دارد. پزشکان توانستهاند با تجویز همزمان آنتیبادیهای ضدلنفوسیتی و سلولهای مغز استخوان فرد دهنده در پریماتهای غیرانسانی تولرانس را القا کنند و نشان دهند افزایش بقاء پیوند آلوگرافت بدون استفاده از رژیمهای سختتر سرکوبگر ایمنی صورت میگیرد. تا بهامروز روشهای گوناگونی برای ارائه سلولهای بنیادی فرد دهنده به گیرنده پیوند ارائه شده است که از آن جمله میتوان به عرضه کل سلولهای تک هستهای موجود در مغز استخوان فرد دهنده، عرضه سلولهای مغز استخوان فرد دهنده که سلولهای Tآن جدا شدهاند و یا عرضه سلولهای دندریتیک نابالغ فرد دهنده اشاره کرد.
مطالعات نشان دادهاند تزریق سلولهای بنیادی خونساز در بافت پیوندی موجب تولرانس و تزریق سلولهایCD34+ محیطی موجب کایمریسم میشود که در طولانیشدن عمر پیوند مؤثر هستند. بنابراین استفاده از سلولهای بنیادی به حرکت درآورده شده باG-CSF ، جداسازی و حتی خلوص آنها و یا استفاده از مغز استخوان فرد دهنده و تزریق آن قبل از پیوند کلیه میتواند آینده بهتری را برای این بیماران ایجاد کند. -
ترمیم بافتهای استخوانی و غضروفی
بافت غضروف نوعی بافت همبند متراکم است که عهده دار سنتز مواد سخت و همچنین استحکام مفاصل است. تنها سلولهای موجود در بافت غضروف کندروسیتها هستند که در افراد بالغ ظرفیت محدودی برای ترمیم و نوسازی دارد. این مسئله حتی درآسیبهای کوچک که در ناشی از تحلیل مفاصل حاصل میشود نیز مشاهده میشود. بیماریهای غضروفی یکی از عوارض مهم در افراد میان سال و سالمند است. این آسیبها در نتیجه نکروز، خارج کردن تومور، تحلیل رفتگی غضروف مفاصل به واسطه استئوآرتریت، تروما و یا ناشی از کاهش غضروف و ساییدگی در اثر تمرینات سخت ورزشی و نظامی ایجاد میشوند. این ضایعات در اکثر موارد به دلیل محدود بودن توان ترمیم در غضروف طبیعی، قابل درمان نیست. از طرفی روشهای جراحی که تا کنون برای ترمیم این ضایعات به کار رفته ناموفق بوده است. هرچند پیوند کندروسیتهای خودی کشت شده در شرایط آزمایشگاه یکی از راههای درمانی در این بیماران است ولی امروزه گرایش زیادی به استفاده از سلولهای بنیادی مزانشیمی، در درمان انواع بیماریها از جمله بیماریهای غضروف مفصلی وجود دارد. سلولهای بنیادی مزانشیمی سلولهای چندتوانی هستند که قادرند سلولهای دودمان استخوانی، چربی و غضروفی را به وجود آورند. این سلولها با استفاده از تکنیکهای استاندارد از مغز استخوان جدا و در محیط آزمایشگاه کشت میشوند. در حال حاضر بعد از ایجاد ساختارهای سه بعدی توسط کلاژن از سلولهای مزانشیمی برای پایداری و ماندگاری بافت پیوند شده در مفصل استفاده میشود.
علاوه بر بیماریهای مفصلی، در افرادی که شکستگی وسیع استخوان دارند و یا کسانی که مورد عمل جراحی مغزی قرار گرفته و کاسه سر آنها برداشته شده و همچنین اشخاصی که استخوانهای آنها بهکندی جوش میخورد، از سلولهای بنیادی برای جوشخوردگی سریع و جلوگیری از عفونتهای بعدی استفاده میشود. در این تکنیک، سلولهای بنیادی مزانشیمی از فرد گرفته و در محیط آزمایشگاه به سلولهای استئوبلاست (استخوانی) تبدیل میشود، سپس این سلولها در کنار بافتهای آسیبدیده استقرار مییابند تا باعث جوشخوردگی سریع این بافتها شوند. در این مورد نیز چون سلولها از خود از فرد گرفته شده است؛ بنابراین مشکل پسزدگی و عوارض جانبی نیز در پی نخواهد داشت. -
بیماریهای چشم
سلولهای بنیادی اپیتلیوم قرنیه، به مقدار فراوان در ناحیه لیمبوس یعنی حد فاصل بین قرنیه و ملتحمه قراردارند. درواقع سلولهای لیمبال منبع اصلی ترمیم اپیتلیوم قرنیه در جراحات و حالات طبیعی هستند که هرگاه به طور جزئی یا کلی تخریب شوند، سطح قرنیه با سلولهای اپیتلیالی ملتحمه همراه با سلولهای جامی پوشانده میشود و استرومای قرنیه دچار التهاب مزمن میگردد. این علائم پاتولوژیکی فرایند conjunctivalisation را نشان میدهد و اساس تشخیص، تعدادی از بیماریهای قرنیهای تحت عنوان نقصان سلولهای بنیادی لیمبال است. پیوند سلولهای بنیادی خودی و یا غیرخودی لیمبال برای بازیابی دید و تشکیل سطح طبیعی قرنیه در این افراد ضروری است. مطالعات بالینی و تجربی اخیر نشان دادهاند میتوان سلولهای لیمبال را بر پرده آمینونی انسانی تکثیر داد و برای بازیابی دید افراد با نقصان سلول بنیادی لیمبال استفاده کرد. -
ضایعات و بیماریهای عصبییکی از نگرانیها و دغدغههای مردم و جامعه پزشکی به ویژه جراحان مغز و اعصاب صدمات نخاعی ناشی از تروما است. در آمریکا سالانه بیش از 10000 نفر دچار ضایعات نخاعی میشوند که در حال حاضر تنها امکان درمانهای نگهدارنده برای آن وجود دارد. این نوع درمانها در بیماران آسیب دیده جدی، علاوه بر تحمیل هزینههای هنگفت درمانی و هدر رفتن وقت تیم درمانی، یأس و ناامیدی بیماران و افراد جامعه و سرخوردگی تیم معالج و در نهایت مرگ مبتلایان را به دنبال دارد. پیشرفتهای بشر در زمینه تولید، تکثیر و تمایز سلولهای بنیادی تا حدودی، این امید را به وجود آورده است که بتوان از این سلولها در مداوای ضایعات عصبی مانند قطع نخاع و بیماریهای عصبی همچون آلزایمر، پارکینسون، MS و غیره نیز بهره برد. در این مورد نیز پس از تهیه سلولهای بنیادی از شخص موردنظر، آنها را به سلول عصبی تبدیل میکنند و برای ترمیم یا مداوا مورد استفاده قرار میدهند. البته بخش اعظم این فناوری، در مرحله آزمایشگاهی است و با پیشرفتهای خوبی همراه بوده است. بهعنوان مثال، طی گزارشی که اخیرا منتشره شده، متخصصان فرانسوی موفق شدهاند با استفاده از سلولهای مزانشیمی، موش قطع نخاع شدهای را تا حدی بهبود بخشند که قادر به حرکت باشد ( البته نه با تعادل صددرصد). این موضوع در صورتیکه با موفقیت نهایی توأم شود، انقلاب بزرگی در پزشکی به شمار میرود.
یک شرکت آمریکایی بنام Osiris که یک مرکز تحقیقاتی خصوصی است و متخصصان ارشد جهان در زمینه سلولهای بنیادی را گرد هم آورده، ادعا کرده است که قادر به مداوای بیماریهایی مانند آلزایمر، پارکینسون، MS با استفاده از سلولهای بنیادی خود شخص است البته در قبال ارائه این خدمات هزینههای بالایی تا حد 100 هزار دلار دریافت میکند. -
ترمیم سوختگیها و ضایعات پوستیجراحات پوستی ناشی از سوختگی یا صدمات دیگر، بسیاری از بیماران را دچار مشکل میکند. در روش معمول برای ترمیم قسمتهای صدمهدیده، از پوست بخشهای سالم بدن استفاده میشود که مشکلاتی را برای بیمار بهوجود میآورد. اما با استفاده از سلولهای بنیادی میتوان سلولهای پوستی را در محیط آزمایشگاه تولید و درترمیم بافتهای صدمهدیده از آنها استفاده کرد. این فناوری در حال حاضر، کاربردی شده و در یکی از بیمارستانهای انگلستان مورد استفاده قرار گرفته است
چشمانداز کاربرد سلولهای بنیادی در دنیا
استخراج، نگهداری و استفاده از سلولهای بنیادی بند ناف
در حال حاضر، یکی از مطرحترین ایدهها در زمینه سلولهای بنیادی، استفاده از قابلیتهای منحصر به فرد سلولهای بنیادی بند ناف ( Cord blood ) است.
 مزیت اصلی این
سلولها آن است که بسیار اولیه ( P rimitive ) بوده و توان تمایز بالایی
دارند. بهطوریکه بر اساس نتایج تحقیقات انجام شده، منشا تمام سلولهایی
که پس از تیمارهای آزمایشگاهی و پیوند به بدن توانستهاند بهطور کامل به
سلولهای عضلانی قلب تمایز یابند، از سلولهای ACC133 + بند ناف بوده است.
البته بر اساس نتایج منتشر شده در برخی از مقالات، علاوه بر سلولهای
مذکور، سلولهای مشتق از مغز استخوان ( BMCs ) شامل تمام انواع منونوکلئرها
( whole MNC population ) و سلولهای ACC133 + مشتق از مغز استخوان هم
قادرند به سلولهای عضلانی قلب تبدیل شوند. البته به نظر میرسد نتایج اخیر
به بررسیها و تحقیقات بیشتری نیاز داشته باشد.
مزیت اصلی این
سلولها آن است که بسیار اولیه ( P rimitive ) بوده و توان تمایز بالایی
دارند. بهطوریکه بر اساس نتایج تحقیقات انجام شده، منشا تمام سلولهایی
که پس از تیمارهای آزمایشگاهی و پیوند به بدن توانستهاند بهطور کامل به
سلولهای عضلانی قلب تمایز یابند، از سلولهای ACC133 + بند ناف بوده است.
البته بر اساس نتایج منتشر شده در برخی از مقالات، علاوه بر سلولهای
مذکور، سلولهای مشتق از مغز استخوان ( BMCs ) شامل تمام انواع منونوکلئرها
( whole MNC population ) و سلولهای ACC133 + مشتق از مغز استخوان هم
قادرند به سلولهای عضلانی قلب تبدیل شوند. البته به نظر میرسد نتایج اخیر
به بررسیها و تحقیقات بیشتری نیاز داشته باشد. استخوان به سلولهای ماهیچهای قلبی انجام شده است، نشان میدهند در تمام موارد، این سلولها از نوع سلولهای ACC133 + با منشا بند ناف بودهاند.
مزیت دیگر این سلولها، نداشتن مشکل دفع پیوند سلولهای بنیادی جنینی است. چراکه از خود فرد اخذ میشوند و در سالهای بعدی زندگی،
 دوباره به
همان شخص تزریق میشوند. بر این اساس، این ایده در دنیا مطرح شده است که
نمونة سلولهای بندناف هر شخص در ابتدای تولد گرفته شود و برای سالهای بعد
برای خود فرد ذخیره شود. حتی در حال حاضر، علیرغم اینکه هنوز وضعیت روشنی
برای پیوند سلولهای بند ناف وجود نداشته و سؤالات زیادی در مورد احتمال
رد پیوند سلولهای بیگانه (هترولوگ) مطرح است؛ اما با اینحال توصیه میشود
برای افرادی که در مراحل وخیم بیماری قلبی بوده و در انتظار دریافت قلب
پیوندی بهسر میبرند، در کنار تجویز داروهای سرکوبکنندة سیستم ایمنی، از
روش پیوند سلولهای بندناف بهعنوان یک روش کمکی استفاده کنیم. با این عمل،
بیمار شانس بیشتری برای زنده ماندن تا زمان دریافت قلب را خواهد داشت. این
روش بهویژه در بیماران کهنسال که سلولهای بنیادی مغز استخوان آنها برای
پیوند کافی نیست، از اهمیت بالاتری برخوردار است. از اینرو، امروزه در
اغلب کشورها بانکهای ویژهای برای جداسازی و نگهداری سلولهای بنیادی
بندناف نوزادان تأسیس شده است.
دوباره به
همان شخص تزریق میشوند. بر این اساس، این ایده در دنیا مطرح شده است که
نمونة سلولهای بندناف هر شخص در ابتدای تولد گرفته شود و برای سالهای بعد
برای خود فرد ذخیره شود. حتی در حال حاضر، علیرغم اینکه هنوز وضعیت روشنی
برای پیوند سلولهای بند ناف وجود نداشته و سؤالات زیادی در مورد احتمال
رد پیوند سلولهای بیگانه (هترولوگ) مطرح است؛ اما با اینحال توصیه میشود
برای افرادی که در مراحل وخیم بیماری قلبی بوده و در انتظار دریافت قلب
پیوندی بهسر میبرند، در کنار تجویز داروهای سرکوبکنندة سیستم ایمنی، از
روش پیوند سلولهای بندناف بهعنوان یک روش کمکی استفاده کنیم. با این عمل،
بیمار شانس بیشتری برای زنده ماندن تا زمان دریافت قلب را خواهد داشت. این
روش بهویژه در بیماران کهنسال که سلولهای بنیادی مغز استخوان آنها برای
پیوند کافی نیست، از اهمیت بالاتری برخوردار است. از اینرو، امروزه در
اغلب کشورها بانکهای ویژهای برای جداسازی و نگهداری سلولهای بنیادی
بندناف نوزادان تأسیس شده است.
سلولدرمانی و مهندسی بافت
تلاش برای تمایز سلولهای بنیادی قبل از پیوند
نکتة دیگری که در زمینة استفاده از سلولهای بنیادی برای درمان بیماریهای مختلف از جمله ضایعات قلبی، قابل توجه است،
 امکان استفاده
از سلولهای تمایزیافته بهجای سلولهای اولیة بنیادی است. در حال حاضر،
فقط از سلولهای بنیادی تمایزنیافته برای این منظور استفاده میشود. اما
تحقیقات زیادی در حال انجام است تا با استفاده از ابزار مهندسی ژنتیک، ایدة
بکارگیری از سلولهای تمایزیافته عملی شود . برای مثال، در مورد سلولهای
ماهیچهای قلب، بسیاری از ژنهای دخیل در تمایز یافتن سلولهای بنیادی به
سلول میوکارد قلب، شناخته شدهاند که از آن جمله میتوان به میوکاردین
(قویترین ژن القاگر در تولید ماهیچة قلبی)، اس آر اف ( Serum Response
Factor )، ژنهای GATA 4 ، 5 GATA و مولکولهای کاردیوگنول C و D (که
تمایز سلولهای بنیادی به سلولهای میوکارد قلب را از 30 درصد به 95 درصد
افزایش میدهند) اشاره کرد. بهعبارت دیگر، با فعال کردن این ژنها در داخل
سلولهای بنیادی میتوان ابتدا در شرایط آزمایشگاهی سلولهای قلبی را تهیه
کرد و سپس آنها را به بیمار پیوند زد.
امکان استفاده
از سلولهای تمایزیافته بهجای سلولهای اولیة بنیادی است. در حال حاضر،
فقط از سلولهای بنیادی تمایزنیافته برای این منظور استفاده میشود. اما
تحقیقات زیادی در حال انجام است تا با استفاده از ابزار مهندسی ژنتیک، ایدة
بکارگیری از سلولهای تمایزیافته عملی شود . برای مثال، در مورد سلولهای
ماهیچهای قلب، بسیاری از ژنهای دخیل در تمایز یافتن سلولهای بنیادی به
سلول میوکارد قلب، شناخته شدهاند که از آن جمله میتوان به میوکاردین
(قویترین ژن القاگر در تولید ماهیچة قلبی)، اس آر اف ( Serum Response
Factor )، ژنهای GATA 4 ، 5 GATA و مولکولهای کاردیوگنول C و D (که
تمایز سلولهای بنیادی به سلولهای میوکارد قلب را از 30 درصد به 95 درصد
افزایش میدهند) اشاره کرد. بهعبارت دیگر، با فعال کردن این ژنها در داخل
سلولهای بنیادی میتوان ابتدا در شرایط آزمایشگاهی سلولهای قلبی را تهیه
کرد و سپس آنها را به بیمار پیوند زد. البته در حال حاضر، مشکلاتی در این مسیر وجود دارد. برای مثال، حتی اگر بتوان مخلوطی با خلوص 95 درصد از سلولهای قلبی را از این طریق بهدست آورد، امکان پیوند آنها به بیمار وجود ندارد؛ چرا که 5 درصد باقیماندة سلولها متفاوت بوده و قابلیت بالایی برای ایجاد سرطان دارند. به هر حال یکی از ایدههای ارزشمند در زمینة سلولدرمانی، تمایز سلولها قبل از پیوند به بدن است که امید میرود برخی از مشکلات تکنیکی آن نیز در آیندة نزدیک حل شود.
استفاده از سلولهای بنیادی برای ترمیم ضایعات کبدی
پیوند سلولهای بنیادی علاوه بر بیماران قلبی در سایر بیماران نیز نتایج خوبی را نشان داده است. برای مثال، در حال حاضر اگر بیماری دچار سرطان کبد باشد،
 جراح
مجبور است برای جلوگیری از انتشار سرطان (متاستاز) به بخشهای دیگر بدن،
بخش سرطانی کبد را نابود کند. برای این منظور معمولاً طی دو عمل جراحی
همزمان که اصطلاحاً پارشیال هپاتکتومی ( Partial Hepatectomia ) و پی وی
ای ( Portal Vein Embolization ) نامیده میشوند، خون ناحیة سرطانی کبد را
قطع میکنند تا بافت سرطانی به تدریج نابود شود. در عین حال چون بخش
باقیماندة کبد باید بتواند وظایف کل کبد را به عهده گیرد، لازم است تا این
اعمال جراحی به نحوی انجام شود که بخش سالم باقیمانده، فرصت تکثیر (
Proliferation ) را پیدا کند و در نهایت عملکرد کبد کامل را ایفا نماید.
برای این منظور، حداقل 6 هفته زمان لازم است تا بخش باقیمانده و سالم کبد
تکثیر شود. اما نتایج تحقیقات نشان داده که با سلولدرمانی و پیوند
سلولهای بنیادی بالغ ردة ACC133 + به بخش سالم کبد، این مدت زمان به 2
هفته کاهش مییابد. با این کار نه تنها کبد فرد بیمار در مدت زمان کمتری
ترمیم میشود، بلکه با خارج کردن سریعتر بخش سرطانی از بدن، احتمال بروز
متاستاز و دستاندازی سرطان به بخشهای دیگر بدن فرد نیز کاهش مییابد.
لازم به ذکر است که بر اساس تحقیقات انجام شده، پیوند سلولهای ACC133 + به
رتها ( Rat نوعی حیوان آزمایشگاهی) باعث افزایش رگزایی در بافت توموری
شده است. البته ما نیز در مرکز خود (واقع در دانشگاه دوسلدورف آلمان) این
عمل را بر روی سه بیمار انجام دادهایم که تاکنون نتایج منفی دربرنداشته
است.
جراح
مجبور است برای جلوگیری از انتشار سرطان (متاستاز) به بخشهای دیگر بدن،
بخش سرطانی کبد را نابود کند. برای این منظور معمولاً طی دو عمل جراحی
همزمان که اصطلاحاً پارشیال هپاتکتومی ( Partial Hepatectomia ) و پی وی
ای ( Portal Vein Embolization ) نامیده میشوند، خون ناحیة سرطانی کبد را
قطع میکنند تا بافت سرطانی به تدریج نابود شود. در عین حال چون بخش
باقیماندة کبد باید بتواند وظایف کل کبد را به عهده گیرد، لازم است تا این
اعمال جراحی به نحوی انجام شود که بخش سالم باقیمانده، فرصت تکثیر (
Proliferation ) را پیدا کند و در نهایت عملکرد کبد کامل را ایفا نماید.
برای این منظور، حداقل 6 هفته زمان لازم است تا بخش باقیمانده و سالم کبد
تکثیر شود. اما نتایج تحقیقات نشان داده که با سلولدرمانی و پیوند
سلولهای بنیادی بالغ ردة ACC133 + به بخش سالم کبد، این مدت زمان به 2
هفته کاهش مییابد. با این کار نه تنها کبد فرد بیمار در مدت زمان کمتری
ترمیم میشود، بلکه با خارج کردن سریعتر بخش سرطانی از بدن، احتمال بروز
متاستاز و دستاندازی سرطان به بخشهای دیگر بدن فرد نیز کاهش مییابد.
لازم به ذکر است که بر اساس تحقیقات انجام شده، پیوند سلولهای ACC133 + به
رتها ( Rat نوعی حیوان آزمایشگاهی) باعث افزایش رگزایی در بافت توموری
شده است. البته ما نیز در مرکز خود (واقع در دانشگاه دوسلدورف آلمان) این
عمل را بر روی سه بیمار انجام دادهایم که تاکنون نتایج منفی دربرنداشته
است. سلول های بنیادی از مغز استخوان تا موی سر
سلول های بنیادی از مغز استخوان تا موی سر
سلولهای بنیادی ( (stem Cell سلول
های اولیه ای هستند که قادر به ایجاد هر نوع سلولی در بدن هستند. این سلول
ها می توانند تحت تأثیر بعضی شرایط فیزیولوژیک یا آزمایشگاهی به سلول هایی
با عملکردهای اختصاصی مانند سلول های عضلانی قلب یا سلول های تولیدکننده
انسولین در پانکراس و... تبدیل شوند.
● خصوصیات سلول های بنیادی
سلول های بنیادی با دیگر انواع سلول های موجود در بدن متفاوت هستند. از
جمله خصوصیات مشترک این سلول ها:
۱) توانایی تکثیر و افزایش تعداد آنها برای مدت طولانی
stem cell ها قادربه تقسیم شدن ( dividing ) ونوسازی خودشان برای مدت
طولانی هستند. پدیده ای که در سلول های عضلانی، خونی و یا عصبی به صورت
طبیعی دیده نمی شود.اما سلول های بنیادی این عمل را بارها و بارها انجام می
دهند. هنگامی که عمل تکثیر برای مدت طولانی اتفاق می افتد آن را
proliferation می نامند.
یک جمعیت آغازگر سلول بنیادی که شروع به proliferation می کند می تواند
میلیون ها سلول را ایجاد کند، حال اگر این سلول ها نیز به مانند سلول های
مادری اولیه غیر تخصصی ( unspecialized ) باشند می گویند که این سلول ها
قادر به long-term self renewal هستند.
۲) توانایی تمایز و تبدیل به سلول های تخصص یافته
در سال های اخیر تحقیقات زیادی در مورد امکان تبدیل سلول بنیادی مخصوص یک
بافت به سلول های تخصصی یک بافت کاملا متفاوت انجام شده است . این فرایند
را در اصطلاح plasticity می نامند. برای مثال تبدیل سلول های بنیادی مغز
استخوان به نورون ها و یا تبدیل سلول های بنیادی کبدی به سلول های تولید
کننده انسولین و یا تبدیل سلول های خون ساز به سلول های عضله قلبی.
این سلول ها پس از دریافت پیام های شیمیایی معین می توانند تمایز حاصل کنند
یا به سلول های تخصص یافته با عملکردهای خاصی، تبدیل شوند . عملکرد این
سلول ها در بدن به این شکل است که به هنگام اختلال و بیماری، تکثیر پیدا
کرده و سلول های جدیدی به بافت ارائه می کنند که اساس سلول های درمانی را
تشکیل می دهد.
فرایندی که در آن سلول های غیرتخصصی به سلول های تخصصی یک بافت خاص تبدیل
می شوند را تمایز( differentiation ) می نامند.
این پدیده تحت تاثیر signalهای داخلی و خارجی قرار می گیرد که بخش مهمی از
تحقیقات امروزه دانشمندان را به خود معطوف کرده است. Internal signals آن
دسته از علائمی هستند که توسط ژن ها کنترل می شود و در واقع به اطلاعاتی
گفته می شود که خصوصیات و عملکرد ساختاری یک سلول را با کد کردن اطلاعات
لازم در یک زنجیره DNA تعیین می کند.
اما منظور از external signals علائمی است که منشا خارج سلولی دارند و شامل
مواد شیمیایی ترشح شده، تماس فیزیکی با سلول های مجاور و مولکول های مخصوص
در محیط میکروسکپی اطراف سلول( microenvironment ) هستند.
سلولهای بنیادی خود بر دو نوع هستند:
▪ سلولهای بنیادی جنینی
▪ سلولهای بنیادی بالغ
در سال ۱۹۶۰ محققان کشف کردند که مغز استخوان دارای حداقل دو نوع سلول
بنیادی است : سلول های بنیادی خون ساز( که انواع سلول های خونی را در بدن
می سازند) و سلول های استرومال( که می توانند بافت های غضروف، استخوان،
چربی و بافت های همبندی فیبروز را در بدن بسازند). در اوایل دهه ۱۹۸۰
میلادی، دانشمندان توانستند سلول های بنیادی را از جنین ابتدایی موش جدا
کنند. بیشتراین دانشمندان معتقد بودند که سلول های عصبی جدید در مغز افراد
بالغ نمی تواند تولید شود تا اینکه در سال ۱۹۹۰ دانشمندان توافق کردند که
مغز بالغین شامل سلول های بنیادی است که قادر به تولید سه نوع اصلی سلول
های مغزی ( که شامل آستروسیت ها، الیگودندروسیت ها (سلول های غیرعصبی) ،
نورون ها (ســلول هـای عصـبی)) است.
سلول های بنیادی افراد بالغ (stem cell adult) در ارگان ها و بافت های
زیادی از بدن جدا شده اند، اما نکته مهم این است که تعداد بسیار محدودی از
این سلول ها در هر بافت وجود دارد که در منطقه خاصی از آن بافت برای سالها
ساکن باقی مانده و با ظهور بیماری یا آسیب بافتی فعال می شوند.
بافت هایی که سلول های بنیادی بالغین در آنها یافت می شوند عبارتند از: مغز
استخوان، خون محیطی، مغز، عروق خونی، پالپ دندان، عضله اسکلتی، پوست، کبد،
پانکراس، قرنیه، شبکیه، سیستم گوارش.
در سال ۱۹۹۸دانشمندان موفق به جدا کردن سلول های بنیادی جنینی انسان و رشد
آنها در محیط آزمایشگاه شدند و این سلول ها را سلول های بنیادی جنینی انسان
نامیدند. این سلول ها همانطور که از نامشان پیداست از جنین های ۳ تا ۵
روزه که از تخمک های آزمایشگاهی بارور می شوند به دست می آیند و در محیط
های اختصاصی کشت داده می شوند.
جنین ۳ تا ۵ روزه را بلاستوسیست می نامند. یک بلاستوسیست توده ای متشکل از
۱۰۰ سلول و یا بیشتر است. سلول های بنیادی سلول های درونی یک بلاستوسیست
هستند که در نهایت به یک سلول ، بافت و یا اندام درون بدن تبدیل می شوند.
دانشمندان سلول های بنیادی را از بلاستوسیست جدا کرده و آنها را درون ظرف
پتری دیش در آزمایشگاه کشت می دهند.
پس از آنکه سلول ها چندین بار تکثیر شدند و میزان آنها از گنجایش ظرف کشت
فراتر رفت آنها را از آن ظرف برداشته و درون چندین ظرف قرار می دهند به این
کار اصطلاحا" پاساژ گفته می شود. سلولهای بنیادی جنینی که چندین ماه بدون
ایجاد تمایز پرورش یافته اند خط سلول بنیادی (cell line) نامیده می شوند.
کار با سلول های بنیادی بالغ سخت تر است. زیرا استخراج و کشت آنها نسبت به
سلول های بنیادی جنینی دشوارتر است.
با این وجود یکی از موانع موجود برای استفاده از سلول های بنیادی جنینی، پس
زدن آن ها توسط سیستم ایمنی است. اگر سلول های بنیادی جنینی اهدا شده به
یک بیمار تزریق شوند ممکن است سیستم ایمنی بدن بیمار این سلول ها را
مهاجمان خارجی تلقی کرده و به آنها حمله کند. اما استفاده از سلولهای
بنیادی بالغ تا حدودی از این مشکل می کاهد. زیرا سیستم ایمنی بدن بیمار
سلولهای بنیادی خود بیمار را پس نمی زند.
سلول های بنیادی بر اساس توانایی تکثیر و تمایز به انواع زیر تقسیم می
شوند:
۱) سلول های بنیادی TOTIPOTENT یا همه توانی:
این سلول ها می توانند به هر نوع سلولی در بدن تغییر پیدا کرده و تبدیل
شوند.از جمله این سلول ها تخمک بارور شده یا سلول های تولید شده در تقسیمات
یک تخمک بارور شده می باشد.
۲) سلول های بنیادی PLURIPOTENT یا پرتوانی :
این سلول ها که از سلول های بنیادی رویان منشا می گیرند، حدود ۴ روز پس از
لقاح به وجود می آیند و می توانند به هر نوع سلولی به جز سلول های بنیادی
همه توانی و سلول های جفت تبدیل شده و تمایز حاصل کنند .
۳) سلول های بنیادی MULTIPOTENT یا چند توانی :
این سلول ها از سلول های بنیادی پرتوانی منشا می گیرند و سلول های تخصص
یافته از آنها ناشی می شوند. برای مثال سلول های بنیادی خون ساز که در مغز
استخوان وجود دارند می توانند به همه انواع سلول موجود در خون تبدیل می
شوند ; مثل گلبول قرمز، گلبول سفید و پلاکت . یا سلول های بنیادی عصبی که
می توانند به سلول های عصبی و سلول های حمایت کننده عصبی تبدیل شوند.
۴) سلول های بنیادی UNIPOTENT یا تک توانی :
این نوع سلول ها می توانند فقط به یک نوع سلول تبدیل شده و آن را تولید
کنند.
● کاربرد سلول های بنیادی
از سلول های بنیادی می توان برای بازسازی سلول ها یا بافت هایی استفاده کرد
که بر اثر بیماری یا جراحت صدمه یافته اند. این نوع درمان به درمان سلولی
معروف است. یکی از کاربردهای بالقوه این شیوه درمان ، تزریق سلول های
بنیادی جنینی در قلب برای بازسازی سلول هایی است که بر اثر حمله قلبی صدمه
دیده اند.
توصیه می شود برای افرادی که در مراحل وخیم بیماری قلبی بوده و در انتظار
دریافت قلب پیوندی به سر می برند، در کنار تجویز داروهای سرکوب کننده سیستم
ایمنی، از روش پیوند سلول های بندناف به عنوان یک روش کمکی استفاده کرد.
بر این اساس، این ایده در دنیا مطرح شده است که نمونه سلول های بندناف هر
شخص در ابتدای تولد گرفته و برای سال های بعد برای خود فرد ذخیره شود. با
این عمل، بیمار شانس بیشتری برای زنده ماندن تا زمان دریافت قلب را خواهد
داشت.
این روش به ویژه در بیماران کهنسال که سلول های بنیادی مغز استخوان آنها
برای پیوند کافی نیست، از اهمیت بالاتری برخوردار است. از این رو، امروزه
در اغلب کشورها بانک های ویژه ای برای جداسازی و نگهداری سلول های بنیادی
بندناف نوزادان تاسیس شده است.
از سلول های بنیادی می توان برای بازسازی سلول های مغزی بیماران مبتلا به
پارکینسون استفاده کرد. این بیماران فاقد سلول هایی هستند که ناقل عصبی
موسوم به دوپامین را تولید می کنند. بدون وجود این پیک شیمیایی حرکت
بیماران مبتلا به پارکینسون نامنظم و منقطع است و این افراد از لرزش های
غیر قابل کنترل رنج می برند.
در تحقیقات انجام شده روی موش ها پژوهشگران سلول های بنیادی جنینی را در
مغز موش های مبتلا به بیماری پارکینسون تزریق کردند و شاهد آن بودند که
سلول های بنیادی ، موش ها را بهبود بخشیدند. دانشمندان امیدوارند که روزی
بتوانند این موفقیت خود را در انسانهای مبتلا به پارکینسون هم تکرار کنند.
با استفاده از سلول های بنیادی می توان یک اندام کامل را در آزمایشگاه
پرورش داده و آن را جایگزین اندامی کنند که بر اثر بیماری آسیب دیده است.
برای این کار باید نوعی چارچوب از جنس پلیمر زیست تجزیه پذیر را به شکل
اندام مورد نظر بسازند و سپس آن را با سلول های بنیادی جنینی یا بالغ بارور
سازند. پس از آن عوامل رشد( growth factor ) مخصوص آن اندام افزوده می
شوند تا پرورش اندام را تحت کنترل و هدایت درآورند.
پس از آنکه چارچوب با بافت خاص آن اندام پوشیده شد آن را به بیمار پیوند می
زنند. با به وجود آمدن بافت از سلول های بنیادی چارچوب تجزیه شده و در
نهایت یک گوش ، کبد یا هر اندام دیگر باقی خواهد ماند.
برای مثال، در حال حاضر اگر بیماری دچار سرطان کبد باشد، جراح مجبور است
برای جلوگیری از انتشار سرطان (متاستاز) به بخش های دیگر بدن، بخش سرطانی
کبد را نابود کند. برای این منظور معمولاً طی دو عمل جراحی همزمان، خون
ناحیه سرطانی کبد را قطع می کنند تا بافت سرطانی به تدریج نابود شود. در
عین حال چون بخش باقیمانده کبد باید بتواند وظایف کل کبد را به عهده گیرد،
لازم است تا این اعمال جراحی به نحوی انجام شود که بخش سالم باقیمانده،
فرصت تکثیر را پیدا کند و در نهایت عملکرد کبد کامل را ایفا کند.
برای این منظور، حداقل ۶ هفته زمان لازم است تا بخش باقیمانده و سالم کبد
تکثیر شود. اما پیوند سلول های بنیادی بخش سالم کبد، این مدت زمان به ۲
هفته کاهش می یابد. با این کار نه تنها کبد فرد بیمار در مدت زمان کمتری
ترمیم می شود، بلکه با خارج کردن سریع تر بخش سرطانی از بدن، احتمال بروز
متاستاز و دست اندازی سرطان به بخش های دیگر بدن فرد نیز کاهش می یابد.
از جمله کاربردهای دیگر سلول های بنیادی، جایگزینی سلول های از بین رفته
انسولین ساز در دیابت نوع ۱ است. از لحاظ تئوری سلول های بنیادی جنینی را
می توان در خارج بدن کشت داد و آنها را با استفاده از روش های مختلفی از
جمله استفاده از "فاکتورهای رشد" به سلول های انسولین ساز تبدیل کرد و وقتی
مقدار کافی از این سلول ها در دسترس باشد می توان از آنها برای درمان هر
فرد دیابتی که نیاز به این سلول ها داشته باشد استفاده کرد.
همچنین می توان این سلول ها را با دستکاری ژنتیکی در برابر سیستم ایمنی شخص
گیرنده و رد پیوند مقاوم کرد، کاری که در مورد سلول های بنیادی بالغ امکان
پذیر نیست. این امکان نیز وجود دارد تا با قرار دادن این سلول ها در یک
ماده غیر ایمنی زا کاری کرد که از رد شدن آنها توسط دستگاه ایمنی جلوگیری
شود و دیگر نیازی به استفاده از داروهای ضد رد پیوند نباشد.
در یکی از تحقیقات جالب که به تازگی در باره سلول های بنیادی در افراد بالغ
صورت گرفت نشان داده شد که اگر سلول های بنیادی موجود در دیواره مجاری غدد
لوزالمعده در بالغین در محیط آزمایشگاه کشت داده شوند می توان با تحریک
آنها، یک توده سلولی درست کرد که نه تنها قادر به ترشح انسولین است بلکه
قادر است تا میزان ترشح را براساس قند خون محیط کم یا زیاد کند، کاری که
برای موفق بودن پیوند بسیار ضروری و حیاتی است.